BIOLOGÍA DEL SUELO
Impacto de los aceites esenciales y monoterpenos sobre la nitrificación y las comunidades microbianas edáficas
Impact of essential oils and monoterpenes on nitrification and edaphic microbial communities
Gisele Lopes de Oliveira1, Romina Aylén Verdenelli2-3*, María Florencia Dominchin2-3,
Julio Alberto Zygadlo2-3, José Manuel Meriles2-3
1 Universidade Federal do Sul da Bahia, Instituto de Humanidades, Artes e Ciências
2 Instituto Multidisciplinario de Biología Vegetal (IMBIV-CONICET).
3 Instituto de Ciencia y Tecnología de los Alimentos (ICTA . F.C.E.Fy Nat - UNC)
* Autor de contacto: rverdenelli@imbiv.unc.edu.ar
Recibido: 10/04/2018
Recibido con revisiones: 11/04/2018
Aceptado: 11/04/2018
Resumen
Los monoterpenos pueden afectar el ciclado de nutrientes debido a que son capaces de alterar las tasas de nitrificación
y las comunidades microbianas edáficas. El presente trabajo estudió el impacto de la aplicación directa de diferentes
aceites esenciales y algunos de sus monoterpenos mayoritarios sobre la nitrificación, funcionalidad y estructura de las
comunidades microbianas del suelo. Los dos monoterpenos seleccionados fueron: 1,8-cineol (1,8-CIN) y α-pineno
(α-PIN). En función de la presencia de dichos monoterpenos, las especies vegetales seleccionadas para la extracción de
los aceites esenciales fueron: Aguaribay (Schinusareira L., Anacardiaceae) (OA) y Eucalipto (Eucalyptus comaldulensis
Dehnh., Myrtaceae) (OE). Los muestreos del suelo fueron realizados a los 0, 10, 30 y 60 días de la aplicación de los
tratamientos. El tratamiento control (CK) mostró los valores más altos de nitrificación durante todo el períodode ensayo
. Sin embargo, la reducción en la nitrificación fue significativa (p≤0.05) para el 1,8-CIN, OE y OA a los días 1, 30 y 60
de incubación, respectivamente. Se observó un aumento de la actividad hidrolizante del diacetato de fluoresceína (FDA)
en los tratamientos con α-PIN, OE y 1,8-CIN a los 10, 30 y 60 días de incubación, respectivamente. Una tendencia
similar fue observada en la actividad deshidrogenasa (DHA). El tratamiento CK mostró una disminución significativa
(p≤0.05) de la biomasa de bacterias Gram-negativas. Las poblaciones de Actinomicetes fueron significativamente
(p≤0.05) menores en el tratamiento CK en comparación a las poblaciones observadas en los tratamientos con aceites
esenciales OA y OE. Por último, la aplicación de ambos aceites esenciales (OA y OE) incrementó la biomasa microbiana
total estimada por perfiles de ácidos grasos fosfolípidicos (PLFA).
Palabras clave: aceites esenciales; monoterpenos, microbiología de suelos, enzimática de suelos.
Abstract
Monoterpenes may affect the nutrient cycling because they are capable of altering nitrification rates and edaphic microbial
communities. The present work studied the impact of the direct application of different essential oils and some
of their major monoterpenes on the nitrification, functionality and structure of soil microbial communities. Two monoterpenes
selected were: 1,8-cineol (1,8-CIN) and α-pinene (α-PIN). The vegetal species selected for the extraction of
the essential oils were: Aguaribay (Schinusareira L., Anacardiaceae) (OA) and Eucalyptus (Eucalyptus comaldulensis
Dehnh., Myrtaceae) (OE). Soil samples were taken at 0, 10, 30 and 60 days after the application of the treatments.
Control treatment (CK) showed the highest nitrification values during the entire period tested. However, the reduction
of the nitrification was significant (p≤0.05) for 1,8-CIN, OE and OA at days 1, 30 and 60 of incubation, respectively.
An increase in hydrolyzing activity of fluorescein diacetate (FDA ) was observed in the treatments with α-PIN, OE and
1,8-CIN at 10, 30 and 60 days of incubation, respectively. A similar trend was observed in the dehydrogenase activity
(DHA). The CK treatment showed significantly (p≤0.05) lower biomass values for Gram-negative bacteria. The populations
of Actinomicetes were significantly (p≤0.05) lower in CK treatment compared to the populations observed in the
treatments with OA and OE essential oils. Finally, the application of both essential oils (OA and OE) increased the total
microbial biomass estimated by phospholipid fatty acids (PLFA).
Key words: essential oils; monoterpenes; soil microbiology; soil enzymatic.
INTRODUCCIÓN
La calidad del suelo involucra propiedades físicas,
químicas y microbiológicas que sustentan la
productividad, la calidad del ambiente y la sanidad
de los cultivos (Doran & Parkin, 1994; Jackson
et al., 2003). Los microorganismos de suelo
son fundamentales para mantener el buen funcionamiento
de los suelos naturales y agrícolas ya
que están involucrados en una gran variedad de
procesos claves, tales como la descomposición de
la materia orgánica (MO), la remoción de toxinas
y el ciclado de nutrientes (carbono (C), nitrógeno
(N), fósforo (P) y azufre (S)). Además, algunos
de estos microorganismos desempeñan un importante
rol en la supresión de enfermedades del
suelo y en la promoción del crecimiento vegetal
(Garveba et al., 2004). El estudio de las comunidades
microbianas del suelo puede proveer una
medida integral de la calidad edáfica. Cambios en
la estructura y funcionalidad de las comunidades
microbianas pueden repercutir sobre la calidad
del suelo y el rinde de los cultivos (Brussaard et
al., 2007). Diversos autores indicaron al estudio
de las comunidades microbianas edáficas como
una potente herramienta para comprender señales
tempranas de alteración o disturbio en el suelo
(Graham &Haynes, 2005).
Los monoterpenos son metabolitos especiales
de los aceites esenciales de innumerables especies
de plantas aromáticas y forestales. Estos compuestos
ingresan en el suelo a través de la descomposición
de hojas senescentes, exudados radicales o
vía deposición volátil de las partes aéreas de las
plantas. Su solubilidad en el suelo se encuentra relacionada
principalmente con la estructura química
característica de estos compuestos (Griffin et al.,
1999). Como consecuencia, los terpenos pueden
ejercer una importante influencia sobre las propiedades
de los ecosistemas edáficos (Wood et al.,
1995). Los monoterpenos poseen una potencial
capacidad de interacción en el ciclado de nutrientes,
son capaces de alterar las tasas de herbivoría ,
de descomposición, mineralización, nitrificación y
desnitrificación (White, 1994).
Se sabe que el contenido de N disponible en el
suelo es un factor limitante en el funcionamiento de
los ecosistemas terrestres (Schlesinger, 1997). Existen
agentes químicos capaces de inhibir o retardar
los procesos de nitrificación en el suelo. La bibliografía
existente sobre inhibidores de nitrificación es
amplia, y se encuentra principalmente focalizada en
el control de la nitrificación del amonio con el objetivo
de aumentar la utilización de N en los cultivos.
En este sentido, los monoterpenos podrían inhibir la
mineralización del N mediante el retraso en los procesos
de nitrificación, por medio del aumento en la
inmovilización de nitratos (N-NO-
3) en relación con el
amonio (N- NH+
4) y/o por medio de la estimulación
de la inmovilización del N mediante materiales ricos
en C (White, 1991).
Diversos autores han recomendado la inclusión
de plantas aromáticas como potencial enmienda
en suelos agrícolas, debido a su multifacética actividad
biológica, principalmente asociada con
compuestos fenólicos y terpénicos presentes en
sus aceites esenciales (Adamczyk et al., 2013;
Kadoglidoua et al., 2014). Por lo tanto, se ha
sugerido que los aceites esenciales y sus monoterpenos
poseen una gran influencia en el ciclo de
los nutrientes, regulando procesos microbianos
edáficos (Kainulainen & Holopainen, 2002).
Distintos autores mostraron que ciertos aceites
esenciales presentes en diferentes especies de
plantas aromáticas fueron capaces de estimular
el crecimiento de poblaciones microbianas del
suelo (Vokou & Liotiri, 1999; Smolander et al.,
2005). En este sentido, Wood et al. (1995) reportaron
que algunos microorganismos pueden
metabolizar aceites esenciales y sus componentes
mayoritarios utilizándolos como fuente de C
y energía. Por otra parte , diversos estudios demostraron
que determinados aceites esenciales
y sus compuestos resultaron tóxicos para ciertos
grupos bacterianos posiblemente debido a su
acoplamiento durante la fosforilación oxidativa y
la inhibición de la síntesis de ATP (Houdkova et
al., 2017). Además, otros autores indicaron que
algunos monoterpenos disminuyeron el contenido
de N y C en la biomasa microbiana del suelo
(Wood et al., 1995; Smolander et al., 2006).
Algunos estudios han propuesto a la aplicación
de monoterpenos puros y/o en mezclas con
agroquímicos como método potencial en el control
de enfermedades en cultivos (Miñambres et
al., 2010). Sin embargo, muy pocos estudios han
evaluado el efecto de los aceites esenciales y sus monoterpenos sobre la estructura y función de
las comunidades microbianas del suelo. En general,
los parámetros fisicoquímicos son indicadores
poco sensibles a cambios drásticos en la
matriz del suelo. Sin embargo, diversos autores
sugirieron que los parámetros microbiológicos y
bioquímicos demostraron ser más significativos
como indicadores tempranos de estrés (Gil-Sotres
et al., 2005; Geisseler et al., 2017). Junto con
la evaluación de estos parámetros, se han intentado
construir diferentes índices para evaluar alteración
y/o calidad de los suelos (Puglisi et al.,
2005; Bastida et al., 2008). En este sentido, algunos
autores concluyeron que la estimación de
la biomasa microbiana y la cuantificación de la
actividad enzimática del suelo resultaron ser importantes
parámetros de calidad edáfica, debido
a que los microorganismos constituyen una parte
vital en la cadena de producción de agroalimentos
(Beelem & Doelman, 1997). Recientemente,
la inclusión de herramientas moleculares (qPCR,
DGGE, T-RFLP) y bioquímicas (enzimática de suelos,
perfiles de fosfolípidos, etc) en el estudio de
las comunidades microbianas han sido de gran
utilidad para determinar cambios de diversidad y
abundancia microbiana en el suelo (Maarit Niemi
et al., 2001). Actualmente, el monitoreo de la calidad
del suelo incluye mediciones de parámetros
bioquímicos como la biomasa microbiana total,
biomasa de taxones, respiración microbiana y actividad
enzimática, entre otros. De esta manera, el
objetivo del presente estudio fue estudiar el efecto
de la aplicación de aceites esenciales y de sus
componentes monoterpénicos sobre los procesos
de nitrificación y calidad microbiológica del suelo.
MATERIALES Y MÉTODOS
Aceites esenciales, monoterpenos
y muestreo del suelo
Los monoterpenos seleccionados para el presente
estudio fueron: 1,8-cineol y α-pineno (Sigma-
Aldrich Argentina). En función de la presencia
mayoritaria de dichos monoterpenos, las especies
vegetales seleccionadas para la extracción de los
aceites esenciales fueron: Aguaribay (Schinusareira
L.,Anacardiaceae) y Eucalipto (Eucalyptus
comaldulensis Dehnh., Myrtaceae). Las especies
fueron recolectadas durante el mes de julio del
2013 en Córdoba, Argentina. El material botánico
recolectado fue identificado y herborizado en
el Herbario de la Universidad Nacional de Córdoba
con números de registro CORD00044091 y
CORD00044093 para Schinusareira L., Anacardiaceae y Eucalyptus comaldulensis Dehnh., Myrtaceae,
respectivamente. Los aceites esenciales
fueron extraídos de hojas frescas de Aguaribay y
Eucalipto, utilizando un destilador de arrastre con
vapor. Finalmente, ambos aceites esenciales fueron
analizados mediante un cromatógrafo gaseoso
(Perkin-Elmer Clarus 600) equipado con detector
de llama (FID) y detector de masa (MS) (Tabla 1).
Tabla 1. Constituyentes principales (%) de los aceites esenciales de hojas de Aguaribay (Schinusareira L., Anacardiaceae) y Eucalipto
(Eucalyptus comaldulensis Dehnh., Myrtaceae)
Table 1. Main constituents (%) of the essential oils of Aguaribay leaves (Schinusareira L., Anacardiaceae) and Eucalyptus
(Eucalyptus comaldulensis Dehnh., Myrtaceae)
El suelo fue recolectado de un pastizal natural,
sin intervención antrópica, ubicado en la localidad
de Córdoba, Argentina. La toma de muestras
se realizó a 15 cm de profundidad. La textura del
suelo fue Franco areno-limoso (arena 16%, limo
55.2%, arcilla 28.8%, materia orgánica (MO)
8.47%, carbono orgánico (CO) 4.91%, nitrógeno
total (NT) 0.416%, relación carbono/nitrógeno
(C/N) 11.8). Con el objeto de eliminar los restos
vegetales y escombros, el suelo fue tamizado
(2mm) y posteriormente almacenado durante 7
días en cámara de cultivo con el objeto de equilibrar
el sistema.
Diseño del experimento
Los tratamientos fueron: 1,8-cineol (1,8-CIN),
α-pineno (α-PIN), aceite esencial de eucalipto
(OE), aceite esencial de aguaribay (OA) y control
(CK). El tratamiento CK consistió en el agregado
de sílice-gel sin aditivos. Para cada tratamiento
se utilizaron 200 g de suelo, con una concentración
del 0.3% de aceite esencial o monoterpeno y
2.7% de sílica-gel en polvo. Los aceites esenciales
y los patrones monoterpénicos se añadieron al
suelo siguiendo la técnica de aplicación mediante
sílica-gel (Adamczyk et al., 2011). Todos los tratamientos
se realizaron por triplicado. El ensayo
fue incubado bajo condiciones controladas de humedad
(60% de la capacidad de campo del suelo)
y temperatura (24°C). La toma de muestras
se realizó a los días 0, 10, 30 y 60 después de
iniciado el ensayo. Cada muestra consistió en la
toma de 50 g de suelo, la cual fue almacenada bajo condiciones apropiadas hasta su posterior
análisis en el laboratorio.
Mineralización de N y tasas de nitrificación
El contenido de NT se determinó mediante un
autoanalizador de nutrientes SmartChem 200
(Westco, Scientific Instruments, Inc.). El método
se basa en la conversión de componentes orgánicos
nitrogenados de origen biológico (tales como
aminoácidos, proteínas y péptidos) en amonio, a
través de un proceso de digestión ácida. El método
se basó en USEPA 351.2 Rev. 2.0 (1993a).
Para la digestión ácida, se disolvieron 134 g de
sulfato de potasio (K2SO4) y 7.3 g de sulfato de
cobre III pentahidratado (CuSO4 • 5H2O) en 800
mL de agua y 134 mL de ácido sulfúrico concentrado
(H2SO4), y se completó con agua a volumen final de 1 L. Se colocaron 10 mL de esta solución
por g de la muestra. En el proceso de digestión se
utilizó una temperatura de 160°C durante 30 min
y 380°C durante 45 min.
Para el análisis de nitratos (N-NO-
3), nitritos
(N-NO-
2) y amonio (N-NH+4) se utilizó el autoanalizador
de nutrientes SmartChem 200 (Westco,
Scientific Instruments, Inc.). La extracción se
realizó con una solución de KCL 2.0 M. El método
empleado en el autoanalizador para N-NO-
3 y N-NO-
2 fue USEPA Method 353.2, Rev. 2.0
(1993b) y para N-NH+
4 fue USEPA 350,1 Rev.
2.0 (1993b).
El porcentaje de nitrificación fue calculado de
acuerdo con Kumar et al. (2007) con la siguiente
ecuación:
Tasa de nitrificación = [(N-NO-
3 + N-NO-
2) x 100]
/ (N-NH+
4 + N-NO-
3 + N-NO -
2)
Actividad enzimática y microbiana
La actividad microbiana total fue estimada
mediante hidrólisis del diacetato de fluoresceína
(FDA) según el protocolo de Adam & Duncan
(2001). El FDA es hidrolizado por enzimas extracelulares
y de membrana, permitiendo la liberación
de un producto final coloreado que puede
medirse por espectrofotometría. Brevemente, en
un tubo para centrífuga se pesó 2 g de suelo y se
agregó 15 mL de buffer fosfato pH 7.6. Para comenzar
la reacción se agregó 0.2 mL de solución
stock de FDA, se tapó y agitó en vortex. Se incubó
a 30°C durante 30 min en un baño termostatizado.
Después del tiempo de incubación se agregó
15 mL de la mezcla cloroformo/metanol 2:1 (v/v)
para detener la reacción y se agitó. Se dejó reposar
durante toda la noche para permitir la separación
de las fases orgánica y acuosa. Una vez
completada la separación de fases, se tomó 2 mL
de la fase superior y se midió en un espectrofotómetro
UV-Vis Perkin-Elmer Lamda 25 a 490 nm.
La actividad deshidrogenasa fue determinada
de acuerdo con la técnica citada por García et
al. (1997). Se expuso 1 g de suelo (60% de su
capacidad de campo) a 0.2 mL de una solución
INT (2-p-iodofenil-3-p-nitrofenil-5-cloruro de feniltetrazolio)
al 0.4% durante 24 horas a 28°C
en oscuridad. El INTF formado (iodo-nitrotetrazolioformazan)
fue extraído con 10 mL de metanol
mediante agitación rápida durante 1 min, y posteriormente
filtrado con papel de filtro Whatman
N°5. El INTF fue medido en espectrofotómetro
(UV-Vis Perkin Elmer Lamda 25) a 485 nm.
Estructura de las comunidades microbianas
La estructura de las comunidades microbianas
del suelo se estudió mediante sus perfiles de
fosfolípidos de ácidos grasos (PLFA). La metodología
de extracción y condiciones de análisis de
los PLFA se realizó de acuerdo con Meriles et al.
(2009), basada en Bossio et al. (1998). En un
tubo para centrífuga se pesó 8 g de suelo y se
agregó 20 mL de una mezcla cloroformo/metanol/
buffer fosfato (1:2:0,8 v/v/v). Luego la muestra
se agitó en vortex y se dejó reposar durante 1
h. El sobrenadante fue filtrado con papel de filtro
Whatman N°5. Este procedimiento se repitió dos
veces. Al tubo con el filtrado obtenido se le agregó
10 mL de cloroformo y 10 mL de buffer fosfato
(pH: 7.4). Se dejó reposar durante 24 horas hasta
la completa separación de las fases orgánica y
acuosa. La fase orgánica fue colectada y el solvente
se evaporó con N2 a 37°C. El residuo se
re-suspendió en 3 mL de cloroformo. Los lípidos
del suelo fueron separados en orden creciente de
polaridad mediante una cromatografía en columna
rellena con 0.5 g de ácido silícico (100-200
Mesh, Sigma St Louis, MO). Los lípidos neutros
y los glicolípidos se eluyeron con 5 mL de cloroformo
y 10 mL de acetona, respectivamente.
La fracción de fosfolípidos se eluyó con el agregado
de 5 mL de metanol. La metilación de los
ácidos grasos se realizó con una solución de 1
mL de metanol/tolueno 1:1 (v/v) y 1 mL de KOH
0.2 M incubados a 37°C durante 15 min. Luego
se agregó 2 mL de agua destilada y 0.3 mL de
ácido acético 1 M. Los ácidos grasos metil esterificados
fueron extraídos con hexano (3 mL) y
la solución fue posteriormente concentrada hasta
sequedad. El residuo obtenido se resuspendió en
30 μL de hexano y se midió en un cromatógrafo
gaseoso (Perkin-Elmer Clarus 600) equipado con
una columna Elite-5 (Crossbond 5% difenil-95%
dimetilpolisiloxano), detector de llama (FID) y detector
de masa (MS). Los ácidos grasos fueron analizados con una pendiente térmica de 180 a
240°C a 4°C min-1 y una velocidad de flujo de 0.8
mL min-1. La cuantificación se realizó mediante
el agregado de un estándar interno (19:0). Los
ácidos grasos fueron identificados mediante una
corrida previa de un estándar de ésteres metílicos
de ácidos grasos bacterianos (Bacterial Acid
Methyl Esters mix, Supelco, Bellefonte, PA ). La
concentración total de PLFA fue estimada mediante
la sumatoria de todos los ácidos grasos de
fosfolípidos identificados y utilizada como estimador
de la biomasa microbiana total (Böhme et al.,
2005). Una nomenclatura estándar fue utilizada
para describir cada PLFA: el número de átomos
de carbono seguido por el número de dobles enlaces,
separados por dos puntos. Las conformaciones
cis y trans son designadas con el sufijo
"c" y "t", respectivamente. Otras notaciones son
"Me" para el grupo metilo, "cy" para los grupos
ciclopropanoicos, y el prefijo "i" y "a" para las ramificaciones
iso- y anteiso- de los ácidos grasos.
Análisis estadísticos
El contenido de N-NO-
3, N-NO-
2, N-H4 +, NT,
tasas de nitrificación, actividades enzimáticas,
biomasa microbiana total y grupos taxonómicos
microbianos estimados mediante perfiles de
PLFAs fueron sometidos a un análisis de varianza
(ANAVA) y test a posteriori LSD (p≤0,05). La
normalidad de los datos fue testeada mediante
la prueba de Shapiro-Wilks modificado. Todos los
análisis estadísticos fueron realizados con el software
INFOSTAT /Professional 2013 (Di Rienzo et
al., 2013).
RESULTADOS Y DISCUSIÓN
Nuestro trabajo tuvo por finalidad el estudio de
la acción directa de los monoterpenos y componentes
de los aceites esenciales sobre la microflora
edáfica, no sólo de sus compuestos volatilizados.
Por este motivo se prescindió de la utilización de
trampas de vapor, y en su lugar, los compuestos
terpénicos puros y los aceites esenciales fueron
agregados al suelo de manera directa, acorde a
procedimientos utilizados por diferentes autores
(Adamczyk et al., 2011).
Nuestro estudio reveló que los aceites esenciales
(OA y OE) afectaron de manera poco clara
el contenido de amonio y nitrato del suelo (Tabla
2). Se observaron reducciones significativas (p≤
0.05) en los contenidos de nitrato en los tratamientos
con α-PIN comparada con CK principalmente
a los 10 y 60 días de incubación. En
todos los días de incubación evaluados, α-PIN
mostró los menores contenidos de nitrato respecto
del resto de los tratamientos. Debido a que los
terpenos pueden actuar como fuente de C para
microorganismos, la disminución en el contenido
de nitrato podría ser causado por un aumento
en el proceso de inmovilización microbiana de N
y/o una inhibición en los procesos de nitrificación
(Marmulla & Harder, 2014). Un resultado similar
fue observado al analizar las tasas de nitrificación
(Figura 1). Excepto para el día 1 de incubación,
CK mostró los valores más altos de nitrificación
durante todo el período ensayado. En tanto que
1,8-CIN, OE y OA registraron una reducción significativa (p≤0.05) de la nitrificación a los 1,
30 y 60 días de incubación, respectivamente. El
tratamiento CK presentó los más bajos contenidos
de amonio (Tabla 2). En general, los valores
más altos de amonio fueron observados en
el suelo tratado con OE y 1,8-CIN hasta el día
30 de incubación. Algunos estudios han reportado
que α-PIN es capaz de inhibir los procesos
de mineralización y/o nitrificación (Uusitalo et al.,
2008). En nuestro estudio, a la concentración y
tipo de suelo ensayado, α-PIN no modificó la mineralización
de N (estimado como contenido de
N-NH+
4). Es posible que este efecto diferencial de
α-PIN sobre la mineralización de N esté relacionado
con la dosis aplicada del monoterpeno y/o el
tipo de suelo (White, 1994). Sin embargo, el presente
trabajo es el primer reporte en informar una
acción inhibitoria de la nitrificación como consecuencia
de la aplicación directa de 1,8-CIN y OE.
Cabe aclarar que dicha inhibición no fue observada
en el OA debido a que al 1,8-CIN no forma
parte constitutiva de los monoterpenos presentes
en el OA. Diferentes autores demostraron que la
inhibición de ambos procesos (mineralización y
nitrificación) es una función de la dosis aplicada
de monoterpenos (White, 1991). Aplicaciones
con dosis bajas o intermedias de monoterpenos
(10-125 μg g-1) mostraron poco o ningún cambio
en la mineralización. Por el contrario, altas dosis
de monoterpenos (1250 μg g-1) estimularon la inmovilización
neta de amonio. Es probable que la
falta de uniformidad en la respuesta de inhibición
en la mineralización y/o nitrificación observada
en nuestro trabajo esté relacionada con bajas dosis de monoterpenos y aceites esenciales. Finalmente,
los tratamientos con aceites esenciales y
monoterpenos afectaron pobremente el contenido
de nitrito. El contenido de nitrógeno total (NT) no
varió entre tratamientos durante la totalidad del
período de incubación (Tabla 2).
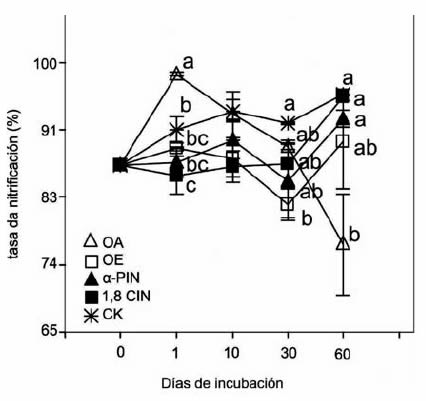
Figura 1. Tasas de nitrificación en suelos tratados con aceites
esenciales y sus monoterpenos. OA: aceite esencial Aguaribay
(Schinusareira L., Anacardiaceae). OE: aceite esencial de
Eucalipto (Eucalyptus comaldulensis Dehnh., Myrtaceae).
α-PIN: α-pineno, 1,8 CIN: 1,8 cineol, CK: control. Letras
diferentes indican diferencias significativas entre tratamientos
a los 0, 1, 10, 30 y 60 días de incubación (p≤0.05).
Figure 1. Nitrification rates in soils treated with essential
oils and their monoterpenes. OA: Aguaribay essential oil
(Schinusareira L., Anacardiaceae). OE: Eucalyptus essential
oil (Eucalyptus comaldulensis Dehnh., Myrtaceae). α-PIN:
α-pineno, 1,8 CIN: 1,8 cineol, CK: control. Different letters
indicate significant differences between treatments at 0, 1, 10,
30 and 60 days of incubation (p≤0.05).
Tabla 2. Concentración de N-NO-
3, N-NO-
2, N-NH+
4 y NT en el suelo tratado con aceites esenciales y terpenos durante 60 días
de incubación. OA: aceite esencial Aguaribay (Schinusareira L., Anacardiaceae). OE: aceite esencial de Eucalipto (Eucalyptus
comaldulensis Dehnh., Myrtaceae). α-PIN: α-pineno, 1,8 CIN: 1,8 cineol, CK: control. Letras diferentes indican diferencias
significativas entre tratamientos a los 0, 1, 10, 30 y 60 días de incubación (p≤0.05).
Table 2. Concentration of N-NO-
3, N-NO- 2, N-NH+ 4 y NT in soil with the application of essential oils and terpenes during
60 days of incubation. OA: Aguaribay essential oil (Schinusareira L., Anacardiaceae). OE: Eucalyptus essential oil (Eucalyptus
comaldulensis Dehnh., Myrtaceae). α-PIN: α-pineno, 1,8 CIN: 1,8 cineol, CK: control. Different letters indicate significant
differences between treatments at 0, 1, 10, 30 and 60 days of incubation (p≤0.05).
La hidrólisis de FDA es llevada a cabo por
exoenzimas y enzimas de membrana. Debido a
la gran variedad de enzimas capaces de degradar
este sustrato, la técnica hidrolizante de FDA ha
sido utilizada como un estimador de la actividad
microbiana total (Adam & Duncan, 2001). En
nuestro trabajo, la actividad FDA varió en función
del tiempo y de los tratamientos (Figura 2). Excepto
en el día 1, se observaron diferencias significativas
(p≤ 0.05) entre los tratamientos. Se registró una alta actividad FDA en tratamientos
con α-PIN, OE y 1,8-CIN en los 10, 30 y 60 días
de incubación, respectivamente. Este resultado
indica que la actividad FDA varió con el tiempo de
incubación. A pesar de esta variación temporal en
el patrón de respuesta, el CK mostró bajos valores
de actividad FDA en todos los días de incubación.
Aunque menos marcada, una tendencia similar
fue observada en la actividad DHA. En el día 60
de incubación, el tratamiento CK mostró valores
significativamente (p≤ 0.05) más bajos que los
encontrados en suelos tratados. Este resultado indica
que el agregado de terpenos puros o de aceites
esenciales es capaz de aumentar la actividad
microbiana del suelo. Además, para ambas actividades
enzimáticas, las mayores diferencias entre
tratamientos fueron observadas hacia los 60
días de incubación. Se observó una significativa
diferencia entre la acción del aceite esencial y su
monoterpeno sobre la actividad microbiana, indicando
un posible efecto sinérgico entre los componentes
de los aceites esenciales (Bakkali et al.,
2008). Según la bibliografía consultada, muy pocos
trabajos han evaluado el efecto del agregado
directo de terpenos al suelo sobre la actividad microbiana
en enzimas generalistas. Sin embargo,
un aumento de la actividad microbiana total ha
sido frecuentemente observada luego de la aplicación
de dosis subletales de biocidas de uso agrícola
(Chowdhury et al., 2008). Recientemente,
Koçak & Darici (2016) compararon la incorporación
al suelo de hojas de laurel (Laurusnobiliscon
L.) con la aplicación directa de 1,8-CIN y concluyeron
que la incorporación de hojas de laurel y la
aplicación de 1,8-CIN incrementaron significativamente
la actividad microbiana edáfica y las tazas
de mineralización de C. Tanto la degradación
de terpenos como los procesos relacionados con la detoxificación celular producen un significativo
incremento en la actividad microbiana (Musilova
et al., 2016). La actividad antimicrobiana de los
monoterpenos ha sido reportada por diversos autores
y se asocia con sus características lipofílicas
(Ludley et al., 2009). Los monoterpenos actúan
por disrupción de la membrana citoplasmática
microbiana, disminuyendo su impermeabilidad a
protones y grandes iones, y cambiando su fluidez
(Bakkali et al., 2008; Ryu et al., 2018). En concordancia
con estos resultados, diversos autores
han observado un incremento a corto plazo de
la actividad enzimática de suelos que han sido
expuestos a diversos aceites esenciales (Vokou &
Liotiri, 1999).
Pocos estudios han evaluado el efecto de terpenos
y/o aceites esenciales sobre la estructura de
las comunidades microbianas edáficas. En el presente
estudio, la aplicación de monoterpenos y/o
aceites esenciales fue capaz de alterar la estructura
de las comunidades microbianas del suelo (Figura
3). Excepto con la aplicación de 1,8-CIN, el
tratamiento CK mostró valores significativamente
menores de bacterias Gram-negativas que el resto
de los tratamientos. En parcial concordancia con
este resultado, diversos autores han informado
que algunos metabolitos secundarios de plantas,
tales como monoterpenos pueden incrementar
las poblaciones de bacterias Gram-negativas, ya
que algunos de estos organismos son capaces
de utilizar estructuras terpénicas como fuente de
carbono (Uhlik et al., 2013). Es posible que el
diferente comportamiento de las comunidades
bacterianas Gram-negativas frente a la aplicación
del 1,8-CIN pueda deberse a su actividad biocida
antimicrobiana, reportada previamente por diferentes
autores (Marmulla & Harder, 2014). Similarmente,
aunque con una tendencia menos marcada,
las menores poblaciones de actinomycetes
fueron detectadas en el tratamiento CK, siendo
significativamente diferente a las poblaciones
encontradas en suelo tratado con ambos aceites
esenciales (OA y OE). La liberación de compuestos
terpénicos desde poblaciones de actinomycetes
y su ruta biosintética han sido descriptas con
anterioridad (Rabe et al., 2013), lo que sugiere
una baja susceptibilidad de estos microorganismos
a terpenos volátiles. Estos resultados son
concordantes con otro estudio en el que se registró
un significativo incremento en poblaciones
de actinomycetes luego de que un suelo cultivado
con ajo fuera tratado con diferentes dosis del monoterpeno
timol (Miñambres et al., 2010). Los
específicos mecanismos por los que estos aceites
esenciales pueden incrementar las poblaciones
de actinomycetes deberán ser investigados en trabajos
futuros. Las bacterias Gram-positivas, biomasa
fúngica y micorrizas vesículo-arbusculares
no fueron afectadas por las concentraciones de
aceites esenciales y monoterpenos utilizados en
el presente trabajo. Sin embargo, la aplicación de
ambos aceites esenciales (OA y OE) incrementó
la biomasa microbiana total. En contraste con
nuestros resultados, Asensio et al. (2012) reportó
que los componentes orgánicos volátiles (conformados
mayoritariamente por compuestos terpénicos)
provenientes de rastrojo forestal pueden
disminuir la biomasa microbiana. Sin embargo,
otros autores han demostrado que algunos compuestos
terpénicos de alto peso molecular, aplicados
de manera directa al suelo, pueden incrementar
la biomasa microbiana total (Adamczyk
et al., 2011). Esta aparente contradicción podría
estar relacionada con la composición y estructura
edáfica, estructura química de los compuestos y/o
dosis terpénica. Los tratamientos con monoterpenos
(1,8-CIN y α-PIN) no incrementaron significativamente
la biomasa microbiana edáfica. Así,
estos resultados sugieren que el incremento de la
biomasa microbiana observada en suelos tratados
con aceites esenciales podría deberse, al menos
en parte, a un efecto sinérgico de sus componentes
(Kalemba & Kunicka, 2003).
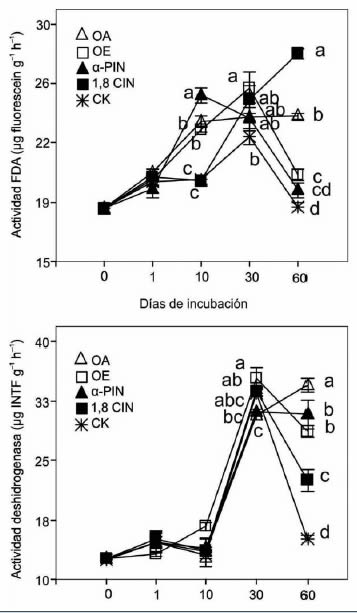
Figura 2. Actividad microbiana en
suelos tratados con aceites esenciales y
sus monoterpenos. OA: aceite esencial
Aguaribay (Schinusareira L., Anacardiaceae).
OE: aceite esencial de Eucalipto (Eucalyptus
comaldulensis Dehnh., Myrtaceae). α-PIN:
α-pineno, 1,8 CIN: 1,8 cineol, CK: control.
Letras diferentes indican diferencias
significativas entre tratamientos a los 0, 1, 10,
30 y 60 días de incubación (p≤0.05).
Figure 2. Microbial activity in soils treated
with essential oils and their monoterpenes.
OA: Aguaribay essential oil (Schinusareira
L., Anacardiaceae). OE: Eucalyptus essential
oil (Eucalyptus comaldulensis Dehnh.,
Myrtaceae). α-PIN: α-pineno, 1,8 CIN: 1,8
cineol, CK: control. Different letters indicate
significant differences between treatments
at 0, 1, 10, 30 and 60 days of incubation
(p≤0.05).
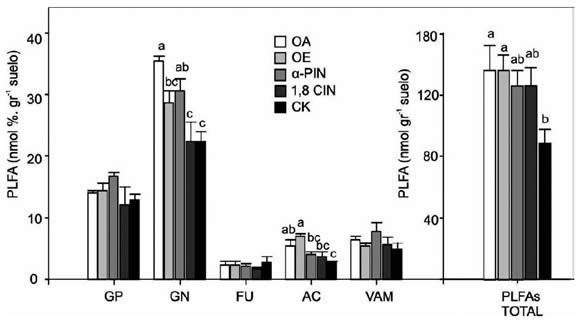
Figura 3. Estructura de las comunidades microbianas estimada por PLFA en suelos tratados con aceites esenciales y sus
monoterpenos. OA: aceite esencial Aguaribay (Schinusareira L., Anacardiaceae). OE: aceite esencial de Eucalipto (Eucalyptus
comaldulensis Dehnh., Myrtaceae). α-PIN: α-pineno, 1,8 CIN: 1,8 cineol, CK: control. GP: Bacterias Gram-positivas, GN: Bacterias
Gram-negativas, FU: Hongos, AC: Actinomicetes, VAM: Micorrizas vesículo-arbusculares. Letras diferentes indican diferencias
significativas entre tratamientos a los 0, 1, 10, 30 y 60 días de incubación (p≤0.05).
Figure 3. Structure of microbial communities estimated by PLFA in soils treated with essential oils and their monoterpenes.
OA: Aguaribay essential oil (Schinusareira L., Anacardiaceae). OE: Eucalyptus essential oil (Eucalyptus comaldulensis Dehnh.,
Myrtaceae). α-PIN: α-pinene, 1,8 CIN: 1,8 cineole, CK: control. GP: Gram-positive bacteria, GN: Gram-negative bacteria, FU: Fungi,
AC: Actinomycetes, VAM: Vesicular-arbuscular mycorrhizae Different letters indicate significant differences between treatments at
0, 1, 10, 30 and 60 days of incubation (p≤0.05).
CONCLUSIONES
La aplicación de aceites esenciales y sus monoterpenos
mayoritarios disminuyó las tazas de
nitrificación sólo en algunos tiempos de incubación.
En general, el suelo tratado con aceites
esenciales y monoterpenos mostró alta actividad
enzimática, especialmente hacia el final del período
de incubación. Por último, la aplicación de
aceites esenciales incrementó las poblaciones de
bacterias Gram-negativas, actinomycetes y biomasa
microbiana total. La potencialidad a campo
de estos productos naturales para controlar las poblaciones microbianas y la actividad enzimática
en diferentes condiciones edáficas necesitan
ser estudiados en trabajos futuros.
AGRADECIMIENTOS
Al Instituto Multidisciplinario de Biología Vegetal
(IMBIV. CONICET - UNC) y al Instituto de Ciencia
y Tecnología de los Alimentos (ICTA - UNC)
donde fue posible la realización de la investigación.
Al Conselho Nacional de Desenvolvimento
Científico e Tecnológico (CNPq). Este trabajo fue
financiado por CONICET y SECyT - UNC.
BIBLIOGRAFIA
1. Adam, G & H Duncan. 2001. Development of a sensitive and
rapid method for measurement of total microbial activity
using fluorescein diacetate (FDA) in a range of soils. Soil
Biol. Biochem. 33: 943-951.
2. Adamczyk, S; B Adamczyk; V Kitunen & A Smolander. 2011.
Influence of diterpenes (colophony and abietic acid) and
a triterpene (beta-sitosterol) on net N mineralization, net
nitrification, soil respiration, and microbial biomass in
birch soil. Biol. Fertil. Soils 47: 715-720.
3. Adamczyk, S; O Kiikkilä; V Kitunen & A Smolander. 2013.
Potential response of soil processes to diterpenes, triterpenes
and tannins: Nitrification, growth of microorganisms
and precipitation of proteins. Applied Soil Ecol.
67: 47-52.
4. Asensio, D; JC Yuste; S Mattana; À Ribas; J Llusià & J Peñuelas.
2012. Litter VOCs induce changes in soil microbial
biomass C and N and largely increase soil CO 2
efflux. Plant Soil 360: 163-174.
5. Bakkali, F; S Averbeck; D Averbeck & M Idaomar. 2008.
Biological effects of essential oils - A review. Food Chem.
Toxicol. 46: 446-475.
6. Bastida, F; A Zsolnay; T Hernández & C García. 2008. Past,
present and future of soil quality indices: a biological
perspective. Geoderma 147: 159-171.
7. Beelem, PV & P Doelman. 1997. Significance and application
of microbial toxicity tests in assessing ecotoxicological
risks of contaminants in soil and sediment. Chemosphere
34: 455-499.
8. Böhme, L; U Langer & F Böhme. 2005. Microbial biomass,
enzyme activities and microbial community structure in
two European long-term field experiments. Agric. Ecosys.
Environ. 109(2): 141-152.
9. Bossio, D; KN Scow & K Graham. 1998. Determinants of
Soil Microbial Communities: Effects of Agricultural Management,
Season, and Soil Type on Phospholipid Fatty
Acid Profiles. Microb. Ecol. 36: 1-12.
10. Brussaard, L; PC de Ruiter & GG Brown. 2007. Soil biodiversity
for agricultural sustainability. Agric. Ecosys. Environ.
121: 233-244.
11. Chowdhury, A; S Pradhan; M Saha & N Sanyal. 2008. Impact
of pesticides on soil microbiological parameters and
possible bioremediation strategies. Indian J. Microbiol.
48(1): 114-127.
12. Di Rienzo, JA; F Casanoves; MG Balzarini; L Gonzalez & M
Tablada. 2013. Infostat - Software estadístico. Grup. InfoStat,
FCA, Univ. Nac. Córdoba, Argentina. URL http://
www.infostat.com.ar
13. Doran, JW & TB Parkin. 1994. Defining and assessing soil
quality. En: JW Doran; DC Coleman; DF Bezdicek & BA
Stewart (Eds.). Defining soil quality for a sustainable environment.
Vol. 35. Pp. 3-21. Madison, WI, USA.
14. García, C; T Hernandez & F Costa. 1997. Potential use of
dehydrogenase activity as an index of microbial activity
in degraded soils. Commun. Soil Sci. Plant Anal. 28:
123-134.
15. Garveba, P; JA van Veen & JD van Elsas. 2004. Microbial diversity
in soil: selection of microbial populations by plant
and soil type and implications for disease suppressiveness.
Annu. Rev. Phytopathol. 42: 243-270.
16. Geisseler, D; BA Linquist & PA Lazicki. 2017. Effect of fertilization
on soil microorganisms in paddy rice systems - A
meta-analysis. Soil Biol. Biochem. 115: 452-460.
17. Gil-Sotres, F; C Trasar-Cepeda; MC Leirós & S Seoane. 2005.
Different approaches to evaluating soil quality using biochemical
properties. Soil Biol. Biochem. 37: 877-887.
18. Graham, M & R Haynes. 2005. Organic matter accumulation
and fertilizer-induced acidification interact to affect
soil microbial and enzyme activity on a long-term sugarcane
management experiment. Biol. Fertil. Soils. 41:
249-256.
19. Griffin, S; SG Wyllie & J Morkhoom. 1999. Determination
of octanol water partition coefficient for terpenoids using
reversed-Phase high-performance liquid chromatography.
J. Cromat. A. 864: 221-228.
20. Houdkova, M; J Rondevaldova; I Doskocil & L Kokoska.
2017. Evaluation of antibacterial potential and toxicity of
plant volatile compounds using new broth microdilution
volatilization method and modified MTT assay. Fitoterapia
118: 56-62.
21. Jackson, LE; FJ Calderon; KL Steenwerth; KM Scow & DE
Rolston. 2003. Responses of soil microbial processes
and community structure to tillage events and implications
for soil quality. Geoderma 114: 305-317.
22. Kadoglidou, K; D Chalkos; K Karamanoli; IG Eleftherohorinos;
HIA Constantinidou & D Vokou. 2014. Aromatic plants as soil amendments: Effects of spearmint and
sage on soil properties, growth and physiology of tomato
seedlings. Scientia Horticulturae 179: 25-35.
23. Kainulainen, P & JK Holopainen. 2002. Concentrations of
secondary compounds in Scot pine needles at different
stages of decomposition. Soil Biol. Biochem. 34. 37-42.
24. Kalemba, D & A Kunicka. 2003. Antibacterial and antifungal
properties of essential oils. Curr. Med. Chem. 10(10):
813-829.
25. Koçak, B & C Darici. 2016. Priming effects of leaves of Laurus
nobilis L. and 1,8-cineole on carbon mineralization.
Chilean J. Agric. Res. 76: 100-104.
26. Kumar R; C Devakumar; V Sharma; G Kakkar; D Kumar &
P Panneerselvam. 2007. Influence of physicochemical
parameters of Neem (Azadirachta indica A Juss) oils on
nitrification inhibition in soil. J. Agric. Food Chem. 55:
1389-1393.
27. Ludley, KE; CH Robinson; S Jickells; PM Chamberlain & J
Whitaker. 2009. Potential for monoterpenes to affect
ectomycorrhizal and saprotrophic fungal activity in coniferous
forests is revealed by novel experimental system.
Soil Biol. Biochem. 41(1): 117-124.
28. Maarit Niemi, R; I Heiskanen; K Wallenius & K Lindstrom.
2001. Extraction and purification of DNA in rhizosphere
soil samples for PCR-DGGE analysis of bacterial consortia.
J. Microbiol. Meth. 45: 155-165.
29. Marmulla, R & J Harder. 2014. Microbial monoterpene transformations
- A review. Front. Microbiol. 5: 346.
30. Meriles, J; S Vargas Gil; C Conforto; G Figoni; E Lovera; G
March & C Guzmán. 2009. Soil microbial communities
under different soybean cropping systems: Characterization
of microbial population dynamics, soil microbial
activity, microbial biomass, and fatty acid profiles. Soil
Tillage Res. 103: 271-281.
31. Miñambres, GG; MY Conles; EI Lucini; RA Verdenelli; JM
Meriles & JA Zygadlo. 2010. Application of thymol and
iprodione to control garlic white rot (Sclerotium cepivorum)
and its effect on soil microbial communities. World
J. Microbiol. Biotechnol. 26: 161-170.
32. Musilova, L; J Ridl; M Polivkova; T Macek & O Uhlik. 2016.
Effects of secondary plant metabolites on microbial populations:
Changes in community structure and metabolic
activity in contaminated environments. Int. J. Molec.
Sci. 17(8): 1205.
33. Puglisi, E; M Nicelli; E Capri; M Trevisan & AAM Del Re.
2005. A soil alteration index based on phospholipid fatty
acids. Chemosphere 61: 1548-1557.
34. Rabe, P; CA Citron & JS Dickschat. 2013. Volatile terpenes
from actinomycetes: a biosynthetic study correlating chemical
analyses to genome data. Chem. Biochem. 14:
2345-2354.
35. Ryu, V; DJ McClements; MG Corradini & L McLandsborough.
2018. Effect of ripening inhibitor type on formation, stability,
and antimicrobial activity of thyme oil nanoemulsion.
Food Chem. 245: 104-111.
36. Schlesinger, WH. 1997. Biogeochemisttry. Academic Press.
San Diego, California. USA.
37. Smolander, A; J Loponon; K Suominen & V Kitunen. 2005.
Organic matter characteristics and C and N transformations
in the humus layer under two tree species, Betula
pendula and Piceaabies. Soil Biol. Biochem. 37: 1309-
1318.
38. Smolander, A; RA Ketola; T Kotiaho; S Kanerva; K Suominen
& V Kitunen. 2006. Volatile monoterpenes in soil
atmosphere under birch and conifers: Effects on soil N
transformations. Soil Biol. Biochem. 38: 3436-3442.
39. Uhlik, O; L Musilova; J Ridl; M Hroudova; C Vlcek; J Koubek;
M Holeckova; M Mackova &T Macek. 2013. Plant
secondary metabolite-induced shifts in bacterial community
structure and degradative ability in contaminated
soil. Appl. Microbiol. Biotech. 97(20): 9245-9256.
40. USEPA , United States Environmental Protection Agency.
1993a. Determination of ammonia nitrogen by semiautomated
colorimetry. Environmental Monitoring Systems
Laboratory. U.S. Environmental Protection Agency,
Cincinnati, OH. URL: http://www.epa.gov/waterscience/
methods/method/files/351_2.pdf
41. USEPA , United States Environmental Protection Agency.
1993b. Determination of nitrate-nitrite nitrogen by semi-
automated colorimetry. Environmental Monitoring
Systems Laboratory. Environmental Protection Agency,
Cincinnati, URL: http://www.epa.gov/waterscience/
methods/method/files/353_2.pdf.URL:http://www.epa.
gov/waterscience/methods/method/files/350_1.pdf
42. Uusitalo, M; V Kitunen V & A Somlander. 2008. Response of
C and N transformations in birch soil to coniferous resin
volátiles. Soil Biol. Biochem. 40: 2643-2649.
43. Vokou, D & S Liotiri. 1999. Stimulation of soil microbial activity
by essential oils. Chemoecology 9(1): 41-45.
44. White, CS. 1991. The role of monoterpenes in soil nitrogen
cycling processes in ponderosa pine. Biogeochem. 12:
43-68.
45. White, CS. 1994. Monoterpenes: Their effects on ecosystem
nutrient cycling. J. Chem. Ecol. 20(6): 1381-1406.
46. Wood, SE; JF Gaskin & JH Langenheim. 1995. Loss of monoterpenes
from Umbellularia californica leaf litter. Biochem.
Syst. Ecol. 23: 581-591.


