FERTILIDAD DE SUELOS Y NUTRICIÓN VEGETAL
Raíces de cultivos de cobertura. Cantidad, distribución e influencia
sobre el N mineral
Juan Agustín Oderiz1; Mauricio Gastón Uhaldegaray1; Ileana Frasier1*;
Alberto Raúl Quiroga1-2; Nilda Amiotti3-4 & Pablo Zalba3
1.EEA INTA Anguil
2.Facultad de Agronomía, UNLPam
3.Departamento de Agronomía, Universidad Nacional del Sur, Bahía Blanca, Argentina
4.CERZOS, CONICET
*Autor de contacto: frasier.ileana@inta.gob.ar
Recibido: 23-02-17
Recibido con revisiones: 28-08-17
Aceptado: 01-09-17
RESUMEN
Los objetivos fueron: i) evaluar la cantidad y distribución de raíces de centeno y vicia como cultivos de cobertura (CC) y; ii)
cuantificar el aporte de N de raíces en el perfil y su impacto sobre la disponibilidad de N-nitratos en el suelo. La experiencia
se desarrolló en dos suelos: Paleustol petrocálcico y Ustipsamment típico y en ensayos de larga duración con rotaciones que
incluyen CC y sorgo o maíz para silo. Los tratamientos fueron un testigo sin CC (T), centeno (C), centeno fertilizado con 60
kg N ha-1 (C+N), vicia (V) y la consociación vicia-centeno (VC) dispuestos en un diseño en bloques completamente aleatorizados
con cuatro réplicas. Al secado de los CC de la campaña 2015 se determinó cantidad, calidad y distribución de raíces hasta el
metro de profundidad estratificando cada 20 cm (BRT), biomasa aérea (BA) y N-nitratos en suelo. En el Ustipsamment la biomasa
de raíces hasta el metro de vicia (3165 kg ha-1) resultó inferior al centeno solo o con N (4459 kg ha-1). En este suelo la gramínea
presentó mayor acumulación de raíces en los primeros 20 cm del perfil (88%) respecto de la leguminosa (62%). En cambio,
en el Paleustol no se observaron diferencias entre V y C o C+N, que en promedio produjeron 4195 kg ha-1 de raíces al metro,
aunque inferiores a VC (5014 kg ha-1). La acumulación en el horizonte superficial en este suelo fue similar entre especies (57%).
En general, la relación BRT/BA en V fue superior a C (0,98 y 0,49, respectivamente). El aporte de N-raíces varió entre 50 y 75
kg ha-1 y se encontró una relación lineal y positiva entre esta variable y el N mineral a partir de los 15-30 días de secados los
CC a 0-20 cm, y a partir de los 45-65 días, para el estrato de 20-100 cm dependiendo del tipo de suelo.
Palabras clave: Vicia; Centeno; Paleustol; Ustipsamment.
Cover crop roots: Quantity, distribution and influence on soil mineral N
ABSTRACT
The objectives of the work were: i) Evaluate the amount and distribution of rye and vetch roots as cover crops (CC); ii) Quantify
the contribution of N-roots in the profile and their impact on N-nitrate availability in the soil. The study was carried out
in two soils: Petrocalcic Paleustoll and Typic Ustipsamment in long duration trials with rotations including CC and sorghum
or maize for silage. Treatments were a control without CC (T), rye (C), rye fertilized with 60N (C+N), vetch (V), and vetchrye consociation (VC) arranged in a completely randomized block design with four replicates. At the end of CC growing season
in 2015 root quantity, quality and distribution up to 1 m depth stratified every 0,20 m (BRT), aerial biomass (BA) and N-nitrates in soil were determined. In the Ustipsamment vetch root biomass at 1 m depth (3165 kg ha-1) was lower than rye
alone or with N (4459 kg ha-1). In this soil, the grass showed higher root biomass accumulation in the first 20 cm (88%)
than the legume (62%). In contrast, in the Paleustoll no differences were found between V and C or C+N, which produced
on average 4195 kg ha-1 of roots at 1 m depth, value that was lower than the corresponding to VC (5014 kg ha-1). In this
soil, BRT in the uppermost soil layer was similar between species (57%). In general, BRT/BA ratio in V was higher than C
(0.98 and 0.49). N-root contribution varied between 50 and 75 kg ha-1. A linear and positive relationship was found between
N-root and mineral N starting from 15-30 days from the end of CC at 0-20 cm depth and from 45-65 days for the 20-100 cm stratum depending on soil type.
Key words: Vetch; Rye; Paleustoll; Ustipsamment.
INTRODUCCIÓN
Los cultivos de cobertura (CC) proveen numerosos
servicios ecosistémicos que han sido ampliamente estudiados (Álvarez et al., 2013; Blanco-Canqui et al., 2015;
Poeplau & Don, 2015; Varela et al., 2017). Muchos de los
beneficios de su uso en sistemas agrícolas han sido relacionados principalmente con su productividad aérea y la
cobertura remanente que dejan sobre la superficie del
suelo. Sin embargo, la contribución de las raíces de los CC
a la dinámica de carbono y el ciclado de nutrientes ha sido
poco estudiada y existe escasa información acerca de la
distribución de raíces en el perfil, la profundidad de exploración máxima según la especie, su composición química
y el impacto de estos residuos sobre las tasas de mineralización de N (Gardner & Sarrantonio, 2012). Comprender
la relación funcional entre estas características de las raíces y el ciclo de N en el suelo ha sido propuesto como uno
de los desafíos actuales (van Groenigen et al., 2015).
El sistema radicular de los cultivos cumple un rol fundamental tanto de anclaje como en la absorción de agua
y nutrientes. En ese sentido, la habilidad del sistema de raíces de explorar el perfil de suelo, y por ende mejorar la -
de agua y nutrientes, condiciona la productividad aérea de
los cultivos (Palta et al., 2011). Estudios previos han evidenciado cambios en el patrón de distribución de raíces co-
mo estrategia para incrementar el volumen explorado en
búsqueda de recursos (Fagioli, 1973; Dwyer et al., 1988;
Trachsel et al., 2013). Sin embargo, la habilidad de las raíces de crecer y explorar el perfil del suelo está condicionada por la resistencia mecánica que ejerce el mismo (Clark et al., 2003). Dicha resistencia puede ser inherente a la génesis del suelo o provocada por acción antrópica. Estudios
previos proponen un rango de 0,8 a 2 MPa como valor crítico de resistencia a la penetración por encima del cual se ve
reducido el crecimiento de las raíces (Bengough et al., 2011).
En la región semiárida pampeana se identifican dos tipos
de suelo de características contrastantes: Molisoles con
presencia de manto calcáreo a profundidad variable (región
de las Planicies con Tosca) y Entisoles sin limitaciones
aparentes en profundidad (región de las Planicies Medanosas). No existe información en la región acerca de la profundidad de exploración de raíces de las diferentes especies que se utilizan como CC en ambos suelos. La bibliografía sugiere valores de exploración de raíces en cereales
invernales (trigo, cebada y avena) que varían entre 0,6 y 2
m de profundidad según la especie utilizada y el tipo de suelo (Fagioli, 1973; Dardanelli et al., 1997; Hoad et al., 2001).
Las raíces también representan un aporte importante
de residuos impactando sobre el ciclado de nutrientes y la
formación de materia orgánica (Maeght et al., 2013). En
ese sentido, la interacción de las raíces con la matriz del suelo
y los microorganismos que habitan en él, genera cambios
en el ambiente circundante relacionados con la formación
de agregados y la estabilización de componentes orgánicos, condicionados a su vez, por su composición granulométrica (Denef & Six, 2006). En ese sentido, las raíces
contribuirían más a la formación de materia orgánica del
suelo que la biomasa aérea de los cultivos, y afectarían de
manera más directa la abundancia de los microorganismos
según plantean los nuevos modelos conceptuales (Kong & Six, 2010; Schmidt et al., 2011; Kätterer et al., 2011;
Cotrufo et al., 2013; Frasier et al., 2016b; c). Existe evidencia que indicaría que el carbono derivado de las raíces formaría agregados más estables que el carbono derivado de
los residuos aéreos (Gale et al., 2000a, b). Por otra parte,
estudios recientes indican que las raíces se descomponen
más rápido que los residuos sobre la superficie del suelo en
condiciones a campo poniendo de manifiesto la importancia del contacto con la matriz del suelo, la temperatura y la
humedad como factores reguladores de su descomposición
(Tahir et al., 2016). La tasa de descomposición de las raíces
también puede variar según el estrato de profundidad de suelo (Gill & Burke, 2002) y la composición química (Georgieva et al., 2005; Redin et al., 2014). Por lo tanto, el estudio de
la distribución de raíces en el perfil y la profundidad máxima
de enraizamiento contribuiría a la comprensión del ciclado
de nutrientes (Jobbágy & Jackson, 2001). Estos antecedentes ponen en evidencia la necesidad de profundizar el estudio de las raíces y su contribución a la dinámica de nutrientes
en los sistemas productivos de la región.
Los objetivos del presente trabajo fueron: i) evaluar la
cantidad y distribución de raíces de centeno y vicia como
CC en dos suelos de diferente granulometría y profundidad de la región semiárida pampeana y; ii) cuantificar el
aporte de N de raíces en el perfil y estudiar su efecto sobre
la disponibilidad de N-nitratos en el suelo.
MATERIALES Y MÉTODOS
Descripción de los sitios y diseño experimental
La experiencia se llevó a cabo durante la campaña 2015
dentro de la Estación Experimental ‘‘Guillermo Covas’’ INTA
Anguil, ubicada en la provincia de La Pampa en dos sitios con
diferentes tipos de suelos característicos de la región. Un Paleustol petrocálcico (Soil Survey Staff USDA NRCS, 2014) con
presencia de un manto calcáreo a partir de los 100 cm de profundidad con las siguientes propiedades edáficas para el estrato de 0-20 cm: 440 g kg-1 de arcilla más limo (A+L), 24 g kg-1 de materia orgánica (MO), 1,2 g kg-1 de nitrógeno total (N), pH
5,9 y 39 mg kg-1 de P Bray (S 36°32’16,75’’; W 63° 59,39’39,21’’).
El segundo suelo es un Ustipsamment típico (Soil Survey Staff
USDA NRCS, 2014) con 120 g kg-1 A+L, 10 g kg-1 MO, 0,6 g kg1
N, pH 6 y 33 mg kg-1 de P Bray (S36°36’37,95’’; W63° 58’48,22’’).Éste no presenta limitaciones en profundidad aunque se caracteriza por el aporte de agua de la capa freática. Ambos sitios
corresponden a ensayos de larga duración establecidos en el
año 2010 con rotaciones que incluyen CC (abril-septiembre)
y sorgo (Sorghum bicolor L. Moench) o maíz (Zea mays L.) para
silaje (noviembre-abril) bajo siembra directa. La precipitación
media anual promedio del área es de 759 mm y la temperatura media de 15 °C (1973-2017). Los tratamientos fueron un
testigo sin CC (T), centeno (Secale cereale L., var. Quehue) (C),
centeno fertilizado con 60 kg N ha-1 (C+N), vicia (Vicia villosa ssp. dasycarpa) (V) y la consociación vicia-centeno (VC). El
diseño experimental fue en bloques completamente aleatorizados con 4 réplicas. La densidad de siembra utilizada fue
de 200 semillas m-2 tanto para vicia como para centeno, y la
misma fue regulada en una proporción 40/60 de centeno y de
vicia para la consociación. Todos los tratamientos fueron fertilizados con fósforo (20 kg P ha-1) a la siembra de los CC. La
fuente nitrogenada utilizada fue urea. El crecimiento de los CC
se detuvo mediante una pulverización combinada con glifosato
(1620 g i.a. ha-1) y 2,4-D (400 g i.a. ha-1) para asegurar el secado
total de la vicia. Las precipitaciones registradas durante el ciclo
de los cultivos de cobertura en ambos sitios fue de 342 mm y
la media anual del 2015 fue de 866 mm. Los tratamientos se
encontraban libres de malezas al momento de las determinaciones.
Determinaciones
Las determinaciones se llevaron a cabo al finalizar el ciclo
de los CC de la campaña 2015. Para evaluar la biomasa de raíces se siguió el método propuesto por Frasier et al. (2016a).
Se trazó en cada parcela una transecta al azar, perpendicular
entre dos líneas de siembra. En cada transecta se realizaron
4 piques equidistantes utilizando un barreno tubular de 3,2 cm
de diámetro interno, de manera tal que, el primer y último
pique coincidiera con las líneas de siembra del cultivo. La profundidad de muestreo fue hasta los 100 cm, con intervalos de
20 cm. Las muestras se almacenaron en freezer (-20 oC) hasta
su procesamiento. Para separar las raíces del suelo se utilizó un tamiz de 250 µm (Barley, 1970) y se aplicó agua a presión.
Las raíces obtenidas en el tamiz se separaron manualmente
de posibles impurezas utilizando una pinza metálica por inmersión en un recipiente con agua. Las raíces recolectadas se
colocaron en estufa a 40 oC por 24 h y se registró su peso seco procediendo a los cálculos de biomasa de raíces totales hasta
el metro de profundidad (BRT) según indica la metodología.
Debido al escaso material radicular recolectado en los estratos inferiores del perfil, las muestras por debajo de los 20 cm
fueron unificadas. Las muestras para los estratos 0-20 y 20-100 cm fueron molidas y se determinó el contenido de N total
por combustión seca empleando un analizador LECO – TrueSpec® CN (LECO Corp., St. Joseph, MI, USA).
Para cuantificar la productividad aérea de los CC se realizó un corte por parcela previo a la finalización de su ciclo de
crecimiento utilizando un aro de 0,25 m2. Las muestras fueron
llevadas inmediatamente al laboratorio y colocadas en estufa a 60
oC por 72 h hasta lograr su peso constante. Se registró el peso seco y se calculó la producción de materia seca de cada
tratamiento. Con dicha información se calculó el cociente entre
la biomasa de raíces hasta el metro de profundidad descontando los valores de los testigos y la biomasa aérea de los CC
(BRT/BA). Por último, al finalizar el ciclo de los CC y a los 15,
30, 45 y 65 días posteriores se tomaron muestras de suelo a
0-20 y 20-100 cm de profundidad para la valoración de N-nitratos por el método colorimétrico del ácido cromotrópico
(West & Ramachandran, 1966).
Los resultados fueron analizados mediante ANOVA utilizando el Test de Fisher para la comparación de medias. La
biomasa total de raíces fue transformada al ln (y) determinada a partir de la pendiente de los gráficos de Box y Cox (Box & Cox, 1964) para asegurar la distribución normal de los datos.
Los resultados presentados corresponden a las medias retransformadas. Se realizó un análisis de regresión lineal para estudiar la relación entre la disponibilidad de N-nitratos y la calidad
de las raíces en los estratos de profundidad de 0-20 y 20 100 cm.
Los análisis estadísticos se realizaron con el software InfoStat
(Di Rienzo et al., 2016).
RESULTADOS Y DISCUSIÓN
La biomasa de raíces hasta el metro de profundidad
estuvo condicionada por el tipo de suelo y el tratamiento
(p=0,0126) (Tabla 1). Mantener el suelo en barbecho
invernal sin CC resultó en un remanente promedio de raíces
en el suelo de 534 y 829 kg MS ha-1 para el Ustipsamment
y el Paleustol, respectivamente. Esta diferencia entre sitios
podría estar asociada con una degradación más lenta de
estos residuos en el suelo de textura más fina como consecuencia de la protección física del material particulado
(Gale et al., 2000a, b; Puget & Drinkwater, 2001; Rasse et
al., 2005; Sanaullah et al., 2011). Incluir CC en la rotación
aportó un plus extra de raíces manteniendo una rizósfera
activa durante todo el año (Frasier et al., 2016c). En el
Ustipsamment la biomasa de raíces de vicia hasta el metro de profundidad resultó inferior al resto de los tratamientos
con la gramínea, con valores promedio de 3165 y 4459 kg
ha-1 respectivamente. Esta menor abundancia de raíces de
vicia en relación al centeno ha sido observada en estudios
previos para una profundidad de 50 cm (Sainju et al., 1998).
Sin embargo, los resultados de este estudio mostraron que
en el suelo de textura más fina (Paleustol) la biomasa de
raíces de vicia alcanzó valores similares a los observados
en los tratamientos con centeno solo o fertilizado con urea
(4195 kg ha-1), aunque inferiores a los registrados en la
consociación (5014 kg ha-1). Por otra parte, la falta de diferencias significativas entre suelos para vicia y centeno en
términos de BRT al metro de profundidad estaría sugiriendo que la presencia de tosca a partir de los 100 cm de profundidad no sería una limitante aparente para el desarrollo radicular. En ese sentido, estudios previos han cuantificado raíces de centeno hasta una profundidad máxima
de 110 cm en un suelo franco-arenoso (Kristensen & Thorup-Kristensen, 2004). Por el contrario, no se han encontrado trabajos que identifiquen la máxima profundidad de raíces en el cultivo de Vicia villosa, aunque la bibliografía indica un valor de 75 cm para Vicia benghalensis L.
de uso forrajero en Entisoles (Hamblin & Hamblin, 1985).
Tabla 1. Biomasa total de raíces de cultivos de cobertura hasta el metro de profundidad del perfil (BRT), su biomasa
aérea (BA) y la relación entre ambas variables (BRT/BA) para dos tipos de suelo: Ustipsamment típico y Paleustol
petrocálcico. Los tratamientos fueron: testigo sin CC (T), centeno (C), centeno +60N (C+N), vicia (V) y consociación
vicia-centeno (VC). Letras diferentes en la misma columna indican diferencias significativas entre medias de
acuerdo a los P valores indicados. Los valores ± corresponden al error estándar.
Table 1. Total root biomass of the cover crop up to 1 m depth (BRT), aerial biomass (BA) and the relationship
between both variables (BRT/BA) for two soils: Typic Ustipsamment and Petrocalcic Paleustoll. Treatments were:
control without CC (T), rye (C), rye + 60N (C+N), vetch (V) and vetch+rye (VC). Means followed by different
letters within the same column are significantly different according to the P values indicated. ± Values indicate
standard errors.
En términos de la productividad aérea de los CC, la vicia
produjo menos biomasa respecto de los tratamientos con
centeno en ambos tipos de suelo (Tabla 1). Similares resultados han sido observados en trabajos previos (Ranells & Wagger, 1997; Sainju et al., 1998; Quiroga et al., 2009;Álvarez et al., 2013). Una de las razones por las cuales se
propone el centeno para su uso como CC está asociada con
su habilidad de capturar nitratos e inmovilizar N en su biomasa
aérea como estrategia para reducir las pérdidas por lixiviación
(Zotarelli et al., 2009; Gabriel & Quemada, 2011; Fernández et al., 2012; Restovich et al., 2012; Restovich & Andriulo,
2013). Sin embargo, su productividad y la respuesta a N se
encuentran condicionadas por la disponibilidad de agua,
principal limitante en regiones semiáridas (Unger & Vigil,
1998; Fernández et al., 2012). En ese sentido, se observó que la productividad aérea de los tratamientos con la gramínea fue superior en el Paleustol respecto del Ustipsamment, asociado probablemente con una mayor capacidad de retención de agua y fertilidad dado que la contribución de las precipitaciones fue similar en ambos sitios de
estudio. Por el contrario, en la campaña evaluada no se
comprobó respuesta por el agregado del fertilizante inorgánico o por la consociación centeno-vicia en los tipos de
suelo estudiados.
La relación entre la biomasa de raíces y la biomasa aérea
ha sido utilizada como un indicador de cambios en la partición de fotoasimilados a estos órganos según la especie
(Iwasa & Roughgarden, 1984) y el ambiente en el cual se
desarrolla (Wilson, 1988). Los resultados de este índice
indicaron que la vicia fue la especie que acusó los valores
más altos en ambos tipos de suelo con magnitudes que
variaron entre 0,89 y 1,08 (Tabla 1). Los pocos estudios
realizados con CC sugieren que la productividad de raíces
puede ser igual o mayor a la productividad aérea de los mismos (Sainju et al. 1998; Gardner & Sarrantonio, 2012). Sin
embargo, en este trabajo esta respuesta sólo se comprobó con la leguminosa, mientras que la gramínea produjo una
biomasa de raíces equivalente al 40-60% de lo producido
en la parte aérea en ambos tipos de suelo. En relación al
efecto del ambiente sobre el balance entre la biomasa de
raíces y la aérea, se asume que la relación entre estas
variables responde a la disponibilidad de nutrientes, aumentando cuando existe una limitante en el suelo
(Andrews et al., 1999; Fageria & Moreira, 2011). Si bien
los resultados indican diferencias en términos de la productividad aérea de los CC entre sitios, la partición entre
raíces y biomasa aérea no estuvo condicionada por el tipo
de suelo.
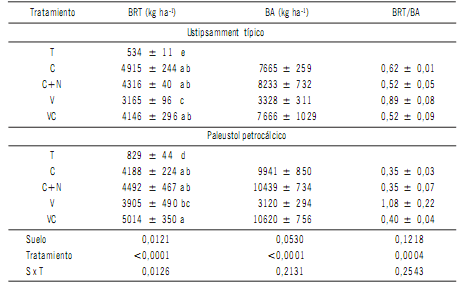
La distribución de raíces en el perfil fue dependiente del
tratamiento y varió según el tipo de suelo (Fig 1). En el
Ustipsamment la biomasa de raíces en los tratamientos con
centeno fue superior al de vicia en los primeros 20 cm (Fig
1a) y fue equivalente al 88% y 62% de las raíces evaluadas
al metro de profundidad para la gramínea y la leguminosa
respectivamente (p=0,0068; DMS=14) (Fig 2). Similar
distribución se observó en el Paleustol aunque con valores inferiores del orden de 55% y 59% para C y V respectivamente. Esta mayor abundancia de raíces en el estrato
superficial se encontraría asociada no solo con la morfología propia de los sistemas radiculares que concentran en
el mismo una mayor proporción de raíces primarias y secundarias sino también con un mayor contenido de materia orgánica, nutrientes, aireación y disponibilidad de agua
comparado con los estratos inferiores del suelo (Stone et
al., 2001; Sainju et al., 2005; Fageria & Moreira, 2011). En
ese sentido, el aporte de N inorgánico al centeno (C+N) incrementó la abundancia de raíces, y por ende su proporción en los primeros 20 cm de suelo, respecto de C en el
Paleustol (Figs 1b y 2). Similar tendencia se observó en el
tratamiento consociado aunque las diferencias respecto
de C no resultaron significativas en dicha profundidad. En
cambio, en el Ustipsamment prácticamente no se observaron cambios en estas variables a lo largo de todo el perfil
(Figs 1a y 2). La vicia tendió a contribuir con la mayor biomasa de raíces por debajo de los 20 cm de profundidad en el
suelo Ustipsamment siendo equivalente al 38% de la totalidad de raíces cuantificadas. Lo mismo ocurrió en el suelo
Paleustol a partir del estrato de 60-80 cm (26%).
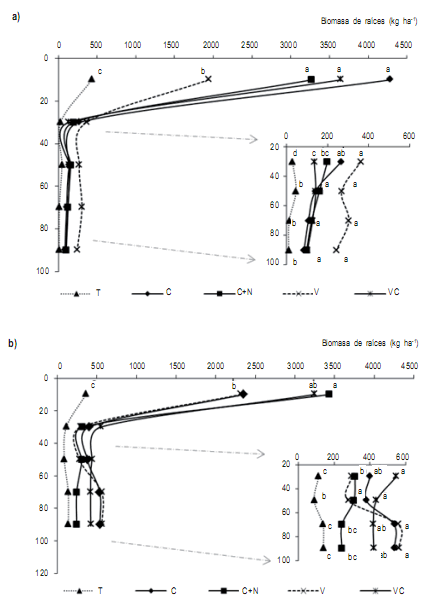
Figura 1. Distribución de biomasa de raíces de cultivos de cobertura (CC) hasta el metro de profundidad para dos suelos: Ustipsamment típico (a)
y Paleustol petrocálcico (b). Los tratamientos fueron: testigo sin CC (T), centeno (C), centeno +60N (C+N), vicia (V) y consociación vicia-centeno
(VC). Letras diferentes indican diferencias significativas entre tratamientos en cada profundidad de suelo (P<0,05).
Figure 1. Cover crop (CC) root biomass distribution up to 1 m depth for two soils: Typic Ustipsamment (a) and Petrocalcic Paleustoll (b). Treatments
were: control without CC (T), rye (C), rye + 60N (C+N), vetch (V) and vetch+rye (VC). Different letters indicate significant differences among treatments
within each depth stratum (P<0.05).
Figura 2. Distribución vertical de la proporción de biomasa de raíces (%) hasta el metro de profundidad en estratos de 20 cm en dos suelos: Ustipsamment
típico (a) y Paleustol petrocálcico (b). Los tratamientos fueron: centeno (C), centeno +60N (C+N), vicia (V) y consociación vicia-centeno (VC) y un
testigo sin CC (T).
Figure 2. Vertical distribution of root biomass proportion (%) between 20 cm and 1 m depth for two soils: Typic Ustipsamment (a) and Petrocalcic
Paleustoll (b). Treatments were: rye (C), rye+60N (C+N), vetch (V), vetch+rye (VC) and a control without CC (T).
Las raíces de los CC contribuyeron con un aporte de N
de raíces hasta el metro de profundidad que varió entre 50
y 75 kg ha-1 según el tratamiento y el tipo de suelo (Fig 3).
La concentración de N de raíces en V fue 2,1% y 1,24%
a 0-20 y 20-100 cm de profundidad, respectivamente (C/N 15 y 16) mientras que para los tratamientos con la gramínea dichos valores promedios fueron 1,4% y 1,05% (C/N 26 y 21). En promedio, incluir CC en la rotación representó un aporte extra de N de raíces del 530% en comparación con las parcelas que permanecieron en barbecho
invernal (T). Este aporte de N de raíces contribuyó al ciclo
del nitrógeno como ha sido evidenciado en estudios previos (Sainju et al., 2005; Frasier et al., 2016c). Se comprobó una relación lineal y positiva entre el N raíces y la disponibilidad de N mineral entre los 15 y 30 días de secados
los CC, dependiendo del tipo de suelo, en el estrato de 0-20 cm de profundidad como consecuencia del proceso de
descomposición y transformación de N orgánico a inorgánico en el suelo. Para el estrato de 20-100 cm esta relación resultó significativa a los 45 y 65 días de la finalización del ciclo de crecimiento de los CC en el suelo Ustipsamment y a los 45 días en el Paleustol, sugiriendo un
retraso en la contribución del N de raíces al N mineral con
el incremento de la profundidad. Sanaullah et al. (2011)
han comprobado una fase de retraso en el desarrollo de la
biomasa microbiana del suelo antes de activar la descomposición de las raíces en profundidad (a partir de los 60 cm)
que podría explicar los resultados obtenidos.
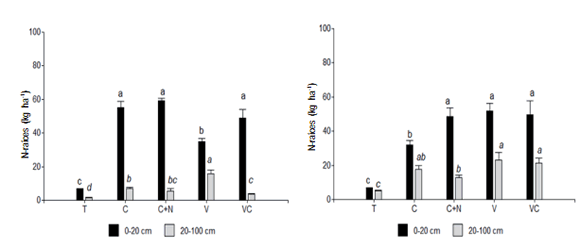
Figura 3. Contenido de N de raíces (kg ha-1) a 0-20 y 20-100 cm de profundidad para dos tipos de suelo: Ustipsamment típico (a) y Paleustol petrocálcico
(b). Los tratamientos fueron: testigo sin CC (T), centeno (C), centeno +60N (C+N), vicia (V) y consociación vicia-centeno (VC). Letras diferentes
indican diferencias significativas entre tratamientos en cada estrato de suelo (P<0,05).
Figure 3. Root-N content (kg ha-1) at 0-20 and 20-100 cm depth for two soils: Typic Ustipsamment (a) and Petrocalcic Paleustoll (b). Treatments were:
control without CC (T), rye (C), rye + 60N (C+N), vetch (V) and vetch+rye (VC). Different letters indicate significant differences among treatments
within each depth stratum (P<0.05).
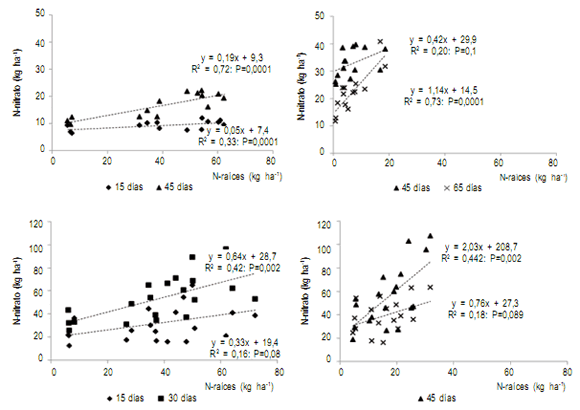
Figura 4. Relación entre la disponibilidad de N-nitratos y el contenido de nitrógeno de raíces a 0-20 (a y c) y 20-100 cm (b y d) de profundidad en los
suelos Ustipsamment típico (a y b) y Paleustol petrocálcico (c y d) respectivamente.
Figure 4. Relationship between nitrate-N availability and root-N content at 0-20 (a and c) and 20-100 cm (b and d) depth for two soils: Typic Ustipsamment
(a and b) and Petrocalcic Paleustoll (c and d).
CONCLUSIONES
La biomasa de raíces de centeno al metro de profundidad varió entre 4100 y 5000 kg MS ha-1 mientras que para vicia el rango de valores estuvo entre 3200 y 3900 kg
MS ha-1. La distribución de raíces en el perfil mostró cambios asociados con la especie utilizada como CC y el aporte
de N (por fertilización o consociación con vicia) que se hicieron evidentes según el tipo de suelo a pesar de la falta
de respuesta en biomasa aérea de los CC. El suelo de granulometría gruesa evidenció una alta acumulación superficial de raíces de la gramínea independiente del aporte o
no de N. En cambio, en el suelo de granulometría más fina
el aporte de N a la gramínea modificó el patrón de distribución de raíces promoviendo una mayor acumulación en
los primeros 20 cm. Una mayor abundancia de nitrógeno
de raíces impactó positivamente sobre la disponibilidad de
nitrógeno mineral en el perfil de suelo.
AGRADECIMIENTOS
Los autores agradecen al Programa Nacional de Agua
(1133033) del Instituto Nacional de Tecnología Agropecuaria por el financiamiento y a la red de trabajo involucrada en el mantenimiento y seguimiento de los ensayos de larga duración de la Estación Experimental ‘‘Guillermo Covas’’ INTA Anguil.
BIBLIOGRAFÍA
1. Álvarez, C; A Quiroga; D Santos & M Bodrero (eds). 2013. Contribuciones de los cultivos de cobertura a la sostenibilidad de los sistemas de producción. INTA, Anguil.
2. Andrews, M; JI Sprent; JA Raven & PE Eady. 1999. Relationships
between shoot to root ratio, growth and leaf soluble protein
concentration of Pisum sativum, Phaseolus vulgaris and Triticumaestivum under different nutrient deficiencies. Plant, Cell Environ.
22(8): 949-958.
3. Barley, KP. 1970. The configuration of the root system in relation
to nutrient uptake. Adv. Agron. 22: 159-201.
4. Bengough, AG; BM McKenzie; PD Hallett & TA Valentine. 2011. Root
elongation, water stress, and mechanical impedance: A review of
limiting stresses and beneficial root tip traits. J. Exp. Bot. 62(1):
59-68.
5. Blanco-Canqui, H; TM Shaver; JL Lindquist; CA Shapiro; RW Elmore;
CA Francis; & GW Hergert. 2015. Cover crops and ecosystem services:
Insights from studies in temperate soils. Agron. J. 107(6): 2449-2474.
6. Box, G & D Cox. 1964. An analysis of transformations. J. R. Stat. Soc.
Ser. B 26(2): 211-252.
7. Clark, LJ; WR Whalley & PB Barraclough. 2003. How do roots penetrate
strong soil? Plant Soil 255(1): 93-104.
8. Cotrufo, MF; MD Wallenstein; CM Boot; K Denef & E Paul. 2013. The
Microbial Efficiency-Matrix Stabilization (MEMS) framework
integrates plant litter decomposition with soil organic matter
stabilization: Do labile plant inputs form stable soil organic matter? Glob. Chang. Biol. 19(4): 988-995.
9. Dardanelli, JL; OA Bachmeier; R Sereno & R Gil. 1997. Rooting depth
and soil water extraction patterns of different crops in a silty loam
Haplustoll. F. Crop. Res. 54(1): 29-38.
10. Denef, K & J Six. 2006. Contributions of incorporated residue and
living roots to aggregate-associated and microbial carbon in two
soils with different clay mineralogy. Eur. J. Soil Sci. 57(6): 774-786.
11. Di Rienzo, JA; F Casanoves; MG Balzarini; L González; M Tablada & CW Robledo. 2016. Grupo InfoStat, FCA, Universidad Nacional de
Córdoba, Argentina. http://www.infostat.com.ar.
12. Dwyer, LM; DW Stewart & D Balchin. 1988. Rooting characteristics
of corn, soybeans and barley as a function of available water and
soil physical characteristics. Can. J. Soil Sci. 68(1): 121-132.
13. Fageria, NK & A Moreira. 2011. The Role of Mineral Nutrition on
Root Growth of Crop Plants. In: DL Sparks (ed). Advances in
Agronomy. Vol. 110. 1er ed. Pp. 251-331. Academic Press.
14. Fagioli, M. 1973. Desarrollo de los aparatos radicales en cultivos de
maíz y trigo en la región de Pergamino. RIA 10(3): 111-135.
15. Fernández, R; A Quiroga & E Noellemeyer. 2012. Cultivos de cobertura, ¿una alternativa viable para la región semirárida pampeana? Cienc. del suelo 30(2): 137-150.
16. Frasier, I; E Noellemeyer; R Fernández & A Quiroga. 2016a. Direct
field method for root biomass quantification in agroecosystems. MethodsX 3: 513-519.
17. Frasier, I; E Noellemeyer; E Figuerola; L Erijman; H Permingeat & A
Quiroga. 2016b. High quality residues from cover crops favor
changes in microbial community and enhance C and N
sequestration. Glob. Ecol. Conserv. 6: 242-256.
18. Frasier, I; A Quiroga & E Noellemeyer. 2016c. Effect of different cover
crops on C and N cycling in sorghum NT systems. Sci. Total Environ.
562: 628-639.
19. Gabriel, JL & M Quemada. 2011. Replacing bare fallow with cover
crops in a maize cropping system: Yield, N uptake and fertilizer fate. Eur. J. Agron. 34(3): 133-143.
20. Gale, WJ; CA Cambardella & TB Bailey. 2000a. Root-derived carbon
and the formation and stabilization of aggregates. Soil Sci. Soc.
Am. J. 64(1): 201-207.
21. Gale, WJ; CA Cambardella & TB Bailey. 2000b. Surface residue-and
root-derived carbon in stable and unstable aggregates. Soil Sci. Soc.
Am. J. 64(1): 196-201.
22. Gardner, M & M Sarrantonio. 2012. Cover crop root composition
and density in a long-term vegetable cropping system trial. J. Sustain.
Agric. 36(6): 719-737.
23. Georgieva, S; S Christensen; H Petersen; P Gjelstrup & K Thorup-Kristensen. 2005. Early decomposer assemblages of soil organisms
in litterbags with vetch and rye roots. Soil Biol. Biochem. 37(6):
1145-1155.
24. Gill, RA & IC Burke. 2002. Influence of soil depth on the decomposition
of Bouteloua gracilis roots in the shortgrass steppe. Plant Soil (241):
233-242.
25. Hamblin, AP & J Hamblin. 1985. Root characteristics of some
temperate legume species and varieties on deep, free-draining
entisols. Aust. J. Agric. Res. 36(1): 63-72.
26. Hoad, SP; G Russell; ME Lucas & IJ Bingham. 2001. The management
of wheat, barley, and oat root systems. Adv. Agron. 74: 193-246.
27. Iwasa, Y & J Roughgarden. 1984. Shoot/root balance of plants: Optimal
growth of a system with many vegetative organs. Theor. Popul.
Biol. 25(1): 78-105.
28. Jobbágy, EG & RB Jackson. 2001. The distribution of soil nutrients
with depth: Global patterns and the imprint of plant. Biogeochemistry 53(1): 51-77.
29. Kätterer, T; MA Bolinder; O Andrén; H Kirchmann & L Menichetti.
2011. Roots contribute more to refractory soil organic matter than
above-ground crop residues, as revealed by a long-term field
experiment. Agric. Ecosyst. Environ. 141(1-2): 184-192.
30. Kong, AY & J Six. 2010. Tracing root vs. residue carbon into soils
from conventional and alternative cropping systems. Soil Sci. Soc.
Am. J. 74(4): 1201-1210.
31. Kristensen, HL & K Thorup-Kristensen. 2004. Root growth and nitrate
uptake of three different catch crops in deep soil layers. Soil Sci.
Soc. Am. J. 68(2): 529-537.
32. Maeght, JL; B Rewald & A Pierret. 2013. How to study deep rootsand why it matters. Front. Plant Sci. 4: 1-14.
33. Palta, JA, X Chen, SP Milroy, GJ Rebetzke, MF Dreccer & M Watt. 2011.
Large root systems: Are they useful in adapting wheat to dry
environments? Funct. Plant Biol. 38: 347-354.
34. Poeplau, C & A Don. 2015. Carbon sequestration in agricultural soils
via cultivation of cover crops - A meta-analysis. Agric. Ecosyst.
Environ. 200: 33-41.
35. Puget, P & LE Drinkwater. 2001. Short-term dynamics of root- and
shoot-derived carbon from a Leguminous Green Manure. Soil Sci.
Soc. Am. J. 65(3): 771-779.
36. Quiroga, AR; R. Fernández; I Frasier & C Scianca. 2009. CULTIVOS
DE COBERTURA. Análisis de su inclusión en distintos sistemas de
producción. Jornadas Nacionales ‘‘Sistemas Productivos
Sustentables: Fósforo, Nitrógeno y Cultivos de Cobertura’’. AACS.
10 y 11 de agosto, Bahía Blanca.
37. Ranells, NN & MG Wagger. 1997. Winter annual grass-legume
bicultures for efficient nitrogen management in no-till corn. Agric.
Ecosyst. Environ. 65(1): 23-32.
38. Rasse, DP; C Rumpel & M-F Dignac. 2005. Is soil carbon mostly root
carbon? Mechanisms for a specific stabilisation. Plant Soil 269(1-2): 341-356.
39. Redin, M; R Guénon; S Recous; R Schmatz; L de Freitas; C Aita & S
Giacomini. 2014. Carbon mineralization in soil of roots from
twenty crop species, as affected by their chemical composition
and botanical family. Plant Soil 378(1-2): 205-214.
40. Restovich, R & A Andriulo. 2013. Cultivos de cobertura en la rotación con soja-maiz: biomasa aérea, captura de nitrógeno, consumo de agua y efecto sobre el rendimiento de grano. p. 195. In:
C Álvarez; AR Quiroga; D Santos; M Bodrero (ed). Contribuciones
de los cultivos de cobertura a la sostenibilidad de los sistemas de
producción. INTA. Anguil.
41. Restovich, SB; AE Andriulo & SI Portela. 2012. Introduction of cover
crops in a maize-soybean rotation of the Humid Pampas: Effect
on nitrogen and water dynamics. F. Crop. Res. 128: 62-70.
42. Sainju, UM; BP Singh & WF Whitehead. 1998. Cover crop root
distribution and its effects on soil nitrogen cycling. Agron. J. 90(4):
511-518.
43. Sainju, UM; BP Singh & WF Whitehead. 2005. Tillage, cover crops
and nitrogen fertilization effects on cotton and sorghum root
biomass, carbon and nitrogen. Agron. J. 97(5): 1279-1290.
44. Sanaullah, M; A Chabbi; J Leifeld; G Bardoux; D Billou & C Rumpel.
2011. Decomposition and stabilization of root litter in top- and
subsoil horizons: what is the difference? Plant Soil 338(1-2): 127-141.
45. Schmidt, MW; MS Torn; S Abiven; T Dittmar; G Guggenberger; IA
Janssens; M Kleber; I Kögel-Knabner; J Lehmann; DA Manning; P
Nannipieri; DP Rasse; S Weiner & SE Trumbore. 2011. Persistence
of soil organic matter as an ecosystem property. Nature 478(7367):
49-56.
46. Soil Survey Staff, USDA-NRCS. 2014. Keys to Soil Taxonomy. 12th
ed.
47. Stone, LR; DE Goodrum; MN Jaafar & AH Khan. 2001. Rooting front
and water depletion depths in grain sorghum and sunflower. Agron.
J. 93(5): 1105-1110.
48. Tahir, MM; S Recous; C Aita; R Schmatz; GE Pilecco & SJ Giacomini.
2016. In situ roots decompose faster than shoots left on the soil
surface under subtropical no-till conditions. Biol. Fertil. Soils 52(6):
853-865.
49. Trachsel, S; SM Kaeppler; KM Brown & JP Lynch. 2013. Maize root
growth angles become steeper under low N conditions. F. Crop.
Res. 140: 18-31.
50. Unger, PW & MF Vigil. 1998. Cover crop effects on soil water
relationships. J. Soil Water Conserv. 53(3): 200-207.
51. van Groenigen, JW; D Huygens; P Boeckx; TW Kuyper; IM Lubbers;
T Rütting & PM Groffman. 2015. The soil N cycle: new insights
and key challenges. Soil 1(1): 235-256.
52. Varela MF, Barraco M, Gili, A, Taboada, MA, Rubio, G. 2017. Biomass
decomposition and phosphorus release from residues of cover crops
under no-tillage. Agronomy Journal 109: 317-326.
53. West, PW & TP Ramachandran. 1966. Spectrophotometric
determination of nitrate using chromotropic acid. Anal. Chim. Acta.
35: 317-324.
54. Wilson, JB. 1988. A review of evidence on the control of shoot:root
ratio in relation to models. Ann. Bot. 61(4): 433-449.
55. Zotarelli, L; L Avila; JM Scholberg & BJ Alves. 2009. Benefits of vetch
and rye cover crops to sweet corn under no-tillage. Agron. J. 101(2):
252-260.




