BIOLOGÍA DEL SUELO
Efecto de la rotación de cultivos en siembra directa sobre la actividad
fosfatasa del suelo
Luciano Andrés Gabbarini1*; Juan Pablo Frene1 & Luis Gabriel Wall1
1. Laboratorio de Biología de Suelos, Universidad Nacional de Quilmes
* Autor de contacto: luciano.gabbarini@gmail.com
Recibido: 27-12-16
Recibido con revisiones: 31-03-17
Aceptado: 14-05-17
RESUMEN
El objetivo del trabajo fue estudiar las variaciones en la actividad enzimática de fosfatasa de suelos agrícolas, comparando el
efecto del monocultivo de soja con la rotación de cultivos, utilizando suelos no cultivados de ambientes naturales como controles. Se determinaron y analizaron los parámetros cinéticos Vmax y Km. Las muestras de suelo fueron tomadas en cuatro
establecimientos productivos de diferentes localidades a lo largo de una transecta de 400 km (este-oeste) en la región núcleo
de la Argentina. Los muestreos, cuatro en total, se realizaron en dos años sucesivos, tanto en verano como en invierno. La
cantidad de enzima fosfomoesterasa en el suelo, estimada como Vmax muestra diferencias significativas entre las prácticas agrícolas. La actividad de fosfomoesterasa mostró un comportamiento estacional opuesto para los suelos sin rotación de cultivos
y no cultivados, mientras que en aquellos suelos agrícolas con rotación de cultivos el comportamiento fue más similar a la
que presentaron los suelos sin agricultura que a los agrícolas sin rotación. Independientemente del sitio de muestreo y de los
tratamientos, los valores de Km no mostraron diferencias pero si se encontró una clara respuesta estacional. Se encontró una
correlación positiva entre la actividad fosfatasa y la biomasa microbiana, pero a partir de la estimación de una actividad específica
se concluye que la biomasa microbiana no puede explicar en su totalidad las diferencias que se encontraron entre tratamientos.
Esto sugiere un aporte significativo de actividad enzimática al suelo dado por los propios cultivos.
Palabras clave: Monocultivo; Biomasa microbiana; Enzimas.
Effect of no-till crop rotation on soil phosphatase activity
ABSTRACT
The aim of this work was to investigate the effects of different no-till agricultural managements related to crop rotation
over soil phosphatase kinetics parameters, Vmax and Km, using grassland soils as references. Treatments were replicated sampling
during summer and winter in four productive fields at different locations along a 400 km east-west transect in the central
Argentinean Pampas, through successive cropping cycles within two years. The quantity of soil phosphatase estimated as Vmax show significant differences between agricultural practices. Opposite seasonal dynamics of phosphatase activities were
found between grassland soils and monocropping agricultural soils while crop rotated. Soils dynamics were more similar to
grassland than to monocropping ones. Regardless of the location and treatment, Km values did not show differences, but
clearly show a seasonal response. A positive correlation was found between phosphatase activities and microbial biomass,
but microbial biomass could not fully explain Vmax values since an estimation of specific activity on the basis of microbial
biomass still show the differences between treatments.
Key words: Monocroping; MIcrobial biomass; Enzymes.
INTRODUCCIÓN
La adopción de las tecnologías de siembra directa (SD)
en los manejos de la agricultura conservacionista ha generado importantes ventajas ambientales y económicas
(Virto et al., 2012). El uso de la SD favorece la acumulación
de carbono (C) orgánico y la preservación del agua en el
suelo, reduciendo el riesgo de erosión hídrica y eólica, especialmente si al manejo de SD se le suma la rotación de
cultivos (Derpsch et al., 2010).
Los niveles de adopción de la SD son cercanos al 8%
en el Mundo y cercano al 80% en la Argentina respecto al
total de la superficie bajo agricultura (Derpsch & Friedrich,
2009; Albertengo et al., 2013). La agricultura bajo SD en
casos en los que su implementación no es acompañada por
la rotación de cultivos pueden presentar un riesgo alto en
la productividad y en el impacto ambiental debido a la disminución de la calidad de suelo (Pittelkow et al., 2015). El
impacto a largo plazo de la rotación de cultivos y las prácticas de fertilización en sistemas de labranza convencional sobre las propiedades físicas y químicas del suelo están
bien documentados (Klose et al., 1999; Moore et al., 2000;
Ekenler & Tabatabai, 2002). Sin embargo, en los suelos bajo SD este tipo de caracterización ha sido menos estudiada.
Un trabajo reciente de escala regional muestra que el
monocultivo de soja bajo SD reduce la diversidad beta
bacteriana mientras que bajo rotación de cultivos este tipo
de diversidad se mantiene en los mismos niveles que los
suelos no agrícolas de ambientes naturales (Figuerola et al., 2014). En otro trabajo, realizado sobre las mismas
muestras de suelo, se observó que los perfiles de ácidos
grasos permiten discriminar entre suelos bajo rotación de
cultivos y monocultivos en SD (Ferrari et al., 2015).
Las actividades enzimáticas del suelo han sido sugeridas como indicadores biológicos de la potencial funcionalidad del suelo debido a que son la expresión de la actividad biológica del suelo y están estrictamente relacionadas al ciclo de los nutrientes y las transformaciones
químicas que ocurren en el suelo (DeForest, 2009; German et al., 2011). Las enzimas responden rápidamente a cambios en el suelo causados por factores naturales o antropogénicos y sus actividades, como velocidades iniciales
de una reacción, se pueden medir de forma sencilla y altamente reproducible (DeForest, 2009; German et al.,
2011). La actividad de la enzima fosfomonoesterasa (FME),
clave en el ciclo del fósforo (P) ha sido muy estudiada en el suelo (Deng & Tabatabai, 1997; Gianfreda et al., 2005).
La FME cataliza la hidrólisis de uniones ester-fosfato
(Nannipieri et al., 2012) y libera un fosfato que puede ser
asimilado por plantas o microorganismos (Deng & Tabatabai, 1997). Se ha mostrado que la actividad de FME,
de igual modo que otras hidrolasas, dependen de numerosos factores tales como las propiedades químicas y físicas del suelo, la presencia o ausencia de organismos en el
suelo, el tipo de cobertura vegetal y la presencia de inhibidores o activadores (Nannipieri et al., 2011; Burns et al., 2013).
En general las actividades enzimáticas del suelo están
relacionadas directamente a la cantidad de biomasa
microbiana (Cmic) presente en el suelo (Ekenler & Tabatabai, 2002; Wang et al., 2015) a pesar de que el origen no
solo corresponde a los microorganismos, sino que también son aportadas por los exudados de las raíces vegetales y la fauna presente en el suelo (Louche et al., 2010;
Nannipieri et al., 2011). En el suelo, cuando se pretende
evaluar la respuesta a un factor de disturbio o estrés, la
medida de la biomasa microbiana tiene una ventaja por
sobre el contenido de materia orgánica total, pues la primera tiene un tiempo de recambio de menos de un año
mientras que la materia orgánica total requiere cerca de
una década para que el cambio sea apreciable (Laudicina et al., 2012). Cuando se utiliza a la biomasa microbiana
como un indicador biológico de calidad de suelo es relevante considerar la variabilidad estacional, debido a la
variación de la temperatura del suelo, la humedad y el aporte
de compuestos orgánicos e inorgánicos (Feng & Simpson,
2009; Ge et al., 2010).
Numerosos indicadores de calidad basados en las propiedades químicas, físicas y biológicas de suelo (Carter,
2002; Romaniuk et al., 2014) se han puesto a prueba en
mayor medida para evaluar la sustentabilidad de los manejos agrícolas bajo el sistema de labranza convencional
(Romaniuk et al., 2011b).
El objetivo de este trabajo fue determinar y evaluar los
parámetros cinéticos de la FME, Km y Vmax, y su relación con
la biomasa microbiana en manejos agrícolas contrastantes
bajo siembra directa, en la región núcleo de la Argentina.
La hipótesis del trabajo es que tanto la actividad FME
como la biomasa microbiana pueden ser sensibles para
diferenciar manejos agrícolas bajo siembra directa en situación de rotación de cultivos y en monocultivo.
MATERIALES Y MÉTODOS
Definición de los tratamientos
Se seleccionaron dos manejos agrícolas como tratamientos contrastantes de acuerdo al encuadramiento de las Buenas Prácticas Agrícolas (BPA) establecida por los principios de
agricultura certificada de la Organización de las Naciones
Unidas para la Alimentación y la Agricultura (FAO, 2007) y
la Asociación Argentina de Productores en Siembra Directa
(AAPRESID, 2014).
El tratamiento Buenas Prácticas Agrícolas (BPA) hace
referencia a un manejo agrícola sustentable bajo SD con rotación de cultivos (trigo-soja maíz-soja), que incluye también
vicia como cultivo de cobertura en invierno. En contraposición
a las BPA, las Pobres Prácticas Agrícolas (PPA) hacen referencia a un manejo no sustentable bajo SD directa y tendencia
al monocultivo de soja (FAO, 2007; AAPRESID, 2014). Asimismo, el Ambiente Natural (AN) es definido como un área de
al menos una hectárea con pastos naturales cercano (menos
de 5 km) a los lotes cultivados donde no se ha realizado agricultura por lo menos en los últimos 30 años (Wall, 2011;
Figuerola et al., 2012).
Los suelos agrícolas se eligieron fijando como criterio una
historia mínima de 15 años con manejos en SD. Las diferencias
entre BPA y PPA están dadas por el régimen de las rotaciones
de los últimos cinco años, siendo que los lotes con BPA tienen
en promedio 62% más de maíz y cultivos de invierno que los
lotes de PPA. El índice de rotación de cultivos, calculado como
el número de cultivos por año fue siempre más alto en BPA
que en PPA para todos los sitios con valores promedio de 1,58
y 1,17, respectivamente.
Sitios de muestreo
Se realizaron 4 réplicas de los tratamientos tomando muestras de situaciones equivalentes en 4 localidades de la Pampa
Central Argentina, cubriendo una distancia de 400 km de este a
oeste. Los sitios de réplica de los muestreos se encuentran en Bengolea (33º01’31"S; 63º37’53"O) y Monte Buey (32º 58’14"S;
62º 27’06"O) en la provincia de Córdoba; Pergamino (33º 56’36"S; 60º33’ 57"O) en la provincia de Buenos Aires, y Viale,
(31º52’59"S; 59º40’07"O) en la provincia de Entre Ríos. Las precipitaciones anuales se incrementan de oeste a este (795 mm
a 1023 mm, Servicio Meteorológico Nacional, registrado a
noviembre de 2012) y la temperatura media anual también
aumenta en el mismo sentido cardinal (16,3 ºC a 18 ºC, Servicio Meteorológico Nacional, registrado a Noviembre de 2012).
Las precipitaciones varían estacionalmente y se concentran
fundamentalmente en primavera y verano (Tabla 1). En los
suelos de los diferentes sitios se observa una variación en la
cantidad y calidad de sus arcillas (Rosa et al., 2014) evidenciándose un aumento en las arcillas y una disminución en el
contenido de arena de oeste (Bengolea) a este (Viale) (Castiglioni et al., 2013). En Bengolea el suelo es Entic Haplustol
franco arenoso, en Monte Buey es Argiudol Típico franco limoso
con un moderado horizonte Bt iluvial y una proporción alta
de limo, en Pergamino es un Argiudol Típico franco limoso con
horizonte Bt bien desarrollado, y en Viale es Hapludert franco
limo-arcilloso (Castiglioni et al., 2013; Duval et al., 2013). Mayor detalle de las diferentes prácticas agrícolas y los ambientes en los distintos sitios pueden encontrarse en los trabajos
de Duval et al. (2013) y Figuerola et al. (2012).
Tabla 1. Precipitaciones y humedad del suelo. Los valores entre paréntesis corresponden a las precipitaciones mínimas y máximas.
Table 1. Precipitations and soil humidity. Values in parentheses are the minimum and maximum precipitations.
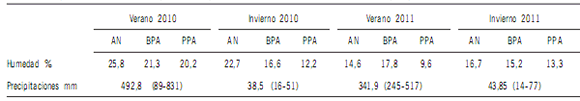
AN: ambiente natural; BPA: buenas prácticas agrícolas; PPA: pobres prácticas agrícolas.
AN: natural environmental; BPA: good agriculture practices; PPA: poor agriculture practices.
En cada tratamiento y en cada sitio se llevó a cabo un muestreo de suelo en verano (febrero) e invierno (septiembre) de
2010 y 2011. En cada muestreo se tomaron tres submuestras
por cada tratamiento a una distancia mínima de 50 m una de
otra. Cada submuestra estuvo compuesta por 16-20 piques de
los 10 cm superficiales de suelo mineral tomados de manera
aleatoria en una superficie de 5 m2 evitando la línea de siembra, que se homogenizaron en el lugar del muestreo para formar
la submuestra. Las submuestras de suelo se transportaron y almacenaron a 4 ºC. Dentro de los tres días después de haber
sido colectadas, las muestras de suelo fueron tamizadas en una
malla de 2 mm y finalmente se almacenaron a 4 ºC hasta su
procesamiento (no más de 2 meses).
Actividad FME del suelo
De cada submuestra, 0,1 g de suelo fue agregado a un tubo
de 20 mL (BMT-20 S, IKA, Germany) junto con 10 esferas de
acero de 5 mm de diámetro y luego resuspendido en 10 mL
de buffer MES (ácido 2-morfolino etano sulfónico) (Sigma-Aldrich Co. Ltd) estéril 0,1M y pH 6,1. La suspensión se homogenizó en un homogeneizador ULTRA TURRAX® Tube Drive
(IKA, Germany) durante dos minutos a 6000 rpm y temperatura ambiente. La suspensión de suelo generada fue inmediatamente utilizada para medir las cinéticas enzimáticas utilizando 200 μL de suspensión de suelo y 80 μL de sustrato MUB-
Fosfato (4-metil umbeliferona-fosfato) por pocillo en una placa
de 96 pocillos. En cada placa se realizaron por triplicado las
mezclas de reacción de la muestra para cada una de las concentraciones de sustrato. Además en todas las placas se realizó un control de sustrato (sustrato + buffer), un control de muestra
(muestra + buffer) y una corrección del quenching (muestra
+ MUB) que sirve para medir el grado de intensidad de la fluorescencia del fluorósforo MUB (4-metil umbeliferona) que se
pierde por la turbidez propia del suelo y los compuestos fenólicos que contiene (Marx et al., 2001). El volumen final de
cada pocillo fue de 280 μL. La fluorescencia de los controles
se restó al valor de las muestras. Como estándar se utilizó MUB
en concentraciones finales de 0, 10, 20, 30, 40, 50, 60 y 70 pmol
por pocillo. El sustrato MUB-fosfato (Sigma-Aldrich Co. Ltd.)
se disolvió en agua estéril y las concentraciones finales en los
pocillos fueron 1, 2, 8, 20, 50, 60, 80 y 90 mM. La intensidad
de la fluorescencia se leyó con una intensidad de 355 nm de
longitud de onda y una emisión de 460 nm de longitud de onda
en el lector de fluorescencia para placas (POLARstar Omega,
BMG LABTECH). El lector de placas fue programado para
realizar 40 ciclos de lectura de 60 seg a 30 ºC.
La velocidad inicial (V0) de la reacción se calculó como la
cantidad de sustrato hidrolizado por unidad de tiempo y se expresó en nmoles de 4-MUB producidos por minuto y por gramo
de suelo seco. Los parámetros cinéticos, Vmax y Km, se estimaron
ajustando los datos experimentales a la ecuación de la hipérbola cuadrática V0 = (VmaxS)/(Km + S) mediante el uso del programa RStudio (RStudio Team (2015). RStudio: Integrated
Development for R. RStudio, Inc., Boston, MA).
Biomasa microbiana
Para esta determinación las muestras fueron previamente secadas por exposición al aire en un cuarto ventilado con
temperatura controlada a 25 ºC durante 72 hs. De cada muestra
y por cuadruplicado se colocaron 7,5 g en tubos cónicos de 50
mL, se agregaron 2,5 mL de agua destilada y se incubaron por
15 h a 30 ºC en oscuridad. Luego de esta incubación, dos de
los tubos se fumigaron con 0,4 mL de cloroformo puro (Carlo
Erba) libre de etanol durante 30 min. Los dos tubos restantes,
sin tratamiento con cloroformo, fueron utilizados como control. El contenido de los cuatro tubos se extrajo inmediatamente
con 30 ml de sulfato de potasio 0,5 M durante 1 h en agitación
a 200 rpm. Finalmente, las muestras se centrifugaron durante
15 min a 800 g (Thermo Electro Corporation, rotor R 8947) y
el sobrenadante se filtró a través de papel de filtro FP0859
(Hahnemühle, German) (Vance et al., 1987).
El carbono de la biomasa microbiana fue estimado por
oxidación con dicromato (Brookes & Joergensen, 2006). Los
resultados se expresaron como el valor promedio respecto a
la curva patrón realizada con glucosa (0,015-0,075 mg.mL-1).
La biomasa microbiana (Cmic) se expresó como microgramos
de carbono oxidable por gramo de suelo seco calculado como
la diferencia entre los valores de los tubos fumigados y no
fumigados (Brookes & Joergensen, 2006).
Datos complementarios
Se utilizan los valores de carbono orgánico total (COT),
nitrógeno total (Nt), fósforo extraíble (Pe), pH y humedad del
suelo que fueron tomados de Duval et al. (2013). Las determinaciones fueron realizadas a partir de las mismas muestras
de suelo.
Análisis estadístico
Los datos experimentales fueron analizados utilizando
modelos lineales generalizados mixtos y análisis multivariados
del tipo de componentes principales (Di Rienzo et al., 2012).
Las comparaciones se hicieron utilizando el test LSD Fisher. Las
correlaciones entre variables se hicieron utilizando el test de
Pearson (α=0,05).
Los resultados mostrados en tablas y figuras fueron analizados de las siguientes formas: a) con los tratamientos como
criterio de clasificación y estación del año y año de muestreo
como variable aleatoria (n=48), b) con la estación del año como
criterio de clasificación y el año como variable aleatoria (n=24),
y c) con el año como criterio de clasificación y la estación del
año como variable aleatoria (n=24).
RESULTADOS
Actividad enzimática y caracterización de Vmax y Km
Las V0
de FME estimadas para cada suspensión de suelo
y con diferentes concentraciones de sustrato se ajustaron
a la ecuación de Michaelis-Menten (r2 > 0,91) permitiendo
la estimación de Vmax y Km aparentes. Los valores de Vmax, Km y Vmax/Km no mostraron interacción entre sitios y tratamientos al ser analizados utilizando modelos lineales
generalizados y mixtos.
Los valores de FME en suelo estimada como el valor de Vmax muestran diferencias significativas (p valor < 0,05) entre tratamientos en siembra directa con BPA y aquel con
tendencia al monocultivo (PPA). Además, los valores de Vmax mostraron diferente comportamiento estacional
dependiendo del tratamiento. Los suelos de PPA muestran
un comportamiento estacional opuesto a los suelos de AN
(Fig 1). Mientras en los AN los valores de actividad FME
disminuyen de verano a invierno, en los suelos bajo PPA
estos valores aumentan. Entre estas dos dinámicas estacionales se encuentran los resultados de BPA que no
mostraron diferencias para Vmax entre las diferentes estaciones en las que se realizó muestreo (Fig 1, Tabla 2). Las
diferencias entre los valores de Vmax de las muestras tomadas en suelos bajo BPA y PPA son significativas tanto en
verano como en invierno (Tabla 2).

Figura 1. Dinámica de la actividad fosfomonoesterasa (FME). Vmax de las
muestras tomadas en verano (blanco) e invierno (gris) de los años 2010
(sin líneas) y 2011 (con líneas). Cada barra es la media ± DE calculados
a partir de las tres muestras tomadas en los cuatro sitios: Bengolea, Monte
Buey, Pergamino y Viale (n=12 para cada tratamiento). Los tratamientos
son ambiente natural (AN), buenas prácticas agrícolas (BPA) y pobres
prácticas agrícolas (PPA). Igual letra por encima de las barras denota que
no existe diferencia significativa (a<0,05) entre las muestras de verano
e invierno para cada tratamiento en 2010 (minúsculas) y 2011 (mayúsculas).
Figure 1. Dynamic of phosphomoesterase (PME) activity. Vmax of summer
(white) and winter (grey) samples taken in 2010 (without stripes) and 2011
(stripes). Each bar is the mean ± SD for three samples in four sites:
Bengolea, Monte Buey, Pergamino y Viale (n=12 in each treatment). The
treatments are natural environmental (AN), good agriculture practices (BPA)
and poor agriculture practices (PPA).Different letters indicate significant
differences (a<0.05) in each treatment for 2010 (lower case) and 2011
(capital letter).
Tabla 2. Parámetros cinéticos (Vmax y Km) para FME y biomasa microbiana (Cmic) en verano e invierno. Todos los valores son expresados por gramo
de suelo seco y son promedios de cuatro réplicas (Bengolea, Monte Buey, Pergamino y Viale) para 2010 y 2011. Los valores con idéntica letra en superíndice
no se diferencian significativamente (α< 0,05). Los valores entre paréntesis corresponden al desvío estándar (n=24).
Table 2. Kinetic parameters (Vmax and Km) of phosphomoesterase and microbial biomass (Cmic) in summer and winter seasons. Values, expresed in
g of dry soil, are mean of four replicates (Bengolea, Monte Buey, Pergamino and Viale) for 2010 and 2011. The values in brackets are the standard
deviation (n=24). Different superscript letters indicate significant differences (α<0.05).
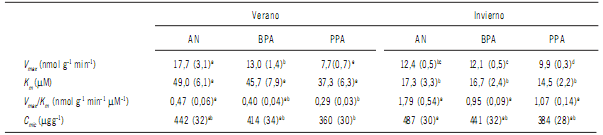
AN: ambiente natural; BPA: buenas prácticas agrícolas; PPA: pobres prácticas agrícolas.
AN: natural environmental; BPA: good agriculture practices; PPA: poor agriculture practices.
Al considerar réplicas a los cuatro muestreos y variables aleatorias a los sitios, las estaciones y el año de muestreo, se encontró que los valores de Vmax son significativamente diferentes siendo AN > BPA > PPA (Tabla 3).
Tabla 3. Parámetros cinéticos (Vmax y Km) para fosfomonoesterasa (FME) y biomasa microbiana
(Cmic). Todos los valores son expresados por gramo de suelo seco y son promedios de cuatro
réplicas (Bengolea, Monte Buey, Pergamino y Viale) para verano e invierno de 2010 y 2011. Los
valores con idéntica letra en superíndice no se diferencian significativamente (α<0,05). Los valores entre paréntesis corresponden al desvío estándar (n=48).
Table 3. Kinetycs parameters (Vmax and Km) of phosphomonoesterase and microbial biomass (Cmic).
Values, expresed in g of dry soil, are mean of four replicates (Bengolea, Monte Buey, Pergamino
and Viale) at summer and winter of 2010 and 2011. The values in brackets are the standard
deviation (n=48). Different superscript letters indicate significant differences (α<0.05).
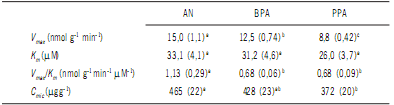
AN: ambiente natural; BPA: buenas prácticas agrícolas; PPA: pobres prácticas agrícolas.
AN: natural environmental; BPA: good agriculture practices; PPA: poor agriculture practices.
Los valores de Km fueron muy similares y no mostraron
diferencias estadísticamente significativas entre los tres
tratamientos bajo estudio (Fig 2 y Tabla 2). Sin embargo
los valores de Km mostraron un claro efecto estacional con
valores para verano significativamente mayores (p valor< 0,001) que para invierno (Fig 2) con valores promedio
de 44,0 y 16,8 μM, respectivamente.
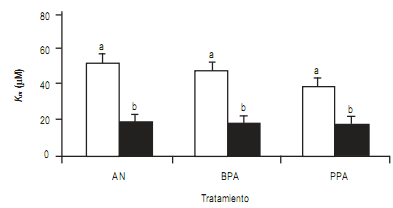
Figura 2. Efecto estacional sobre el Km de fosfomonoesterasa (FME). Cada barra es la media ± DE calculados a partir de los muestreos de verano
(blanco) e invierno (negro) de tres muestras tomadas en los cuatro sitios: Bengolea, Monte Buey, Pergamino y Viale en los años 2010 y 2011(n=24
para cada tratamiento). Los tratamientos son ambiente natural (AN), buenas prácticas agrícolas (BPA) y pobres prácticas agrícolas (PPA). Igual letra
por encima de las barras denota que no existe diferencia entre las muestras (α<0,05).
Figure 2. Seasonal effect over Km of phosphomoesterase (PME). Each bar is the mean ± SD for three samples in four sites: Bengolea, Monte Buey,
Pergamino y Viale (n=24 in each treatment) for summer (white) and winter (black). The treatments are natural environmental (AN), good agriculture
practices (BPA) and poor agriculture practices (PPA).Different letters indicate significant differences (α<0.05).
La relación Vmax/Km se utiliza para caracterizar la actividad catalítica de una enzimática determinada (Das et al.,
1997). En éste caso, los valores no se vieron afectados por
la rotación de cultivos, BPA y PPA no mostraron diferencia significativa. Sin embargo, mostraron valores para los tratamientos bajo SD (BPA y PPA) estadísticamente más pequeños que para AN (Tabla 3) cuando se tomaron en cuenta
los valores en promedio para los dos años evaluados
Biomasa microbiana
La biomasa microbiana fue mínimamente afectada por
la rotación de cultivos. No obstante, la biomasa microbiana
en el tratamiento bajo PPA fue menor a los otros tratamientos pero no alcanzan a ser significativamente diferentes en
ninguno de los muestreos realizados (Tabla 2). En cambio,
cuando el test comparativo se realizó tomando a la estación y al año de muestreo como variables aleatorias los
tratamientos AN y PPA fueron significativamente diferentes entre sí (Tabla 3). El tratamiento bajo BPA que presenta un valor de biomasa microbiana intermedio entre AN
y PPA no se diferenció estadísticamente de ninguno de ellos
(Tabla 3).
Relación Vmax/Cmic
La relación Vmax/Cmic
referida como la eficiencia
enzimática por otros autores (Allison et al., 2007) se utilizó como una manera de estimar la actividad específica de
los suelos (unidades de actividad por gramo de Cmic). En las
muestras de verano, ésta relación mostró la tendencia
AN>BPA>PPA con diferencia significativa (p valor<0,05)
entre BPA y PPA. Mientras tanto, las muestras tomadas en
invierno presentaron valores más pequeños y sin una
tendencia entre los tratamientos (Fig 3).
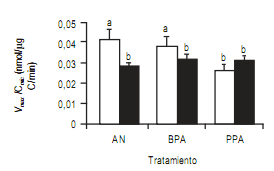
Figura 3. Efecto estacional sobre la actividad específica Vmax/Cmic. Cada barra es la media ± DE calculados a partir de los muestreos de verano (blanco)
e invierno (negro) de tres muestras tomadas en los cuatro sitios: Bengolea, Monte Buey, Pergamino y Viale en los años 2010 y 2011(n=24 para cada
tratamiento). Los tratamientos son ambiente natural (AN), buenas prácticas agrícolas (BPA) y pobres prácticas agrícolas (PPA). Igual letra por encima
de las barras denota que no existe diferencia entre las muestras (α<0,05).
Figure 3. Seasonal effect over specific activity Vmax/Cmic. Each bar is the mean ± SD for 3 samples in four sites: Bengolea, Monte Buey, Pergamino
and Viale (n=24 in each treatment) for summer (white) and winter (black) of 2010 and 2011. The treatments are natural environmental (AN), good
agriculture practices (BPA) and poor agriculture practices (PPA).Different letters indicate significant differences (α<0.05).
Análislis de componentes principales
Se realizó un análisis multivariado de la base de datos
considerando Vmax, Km, Cmic, sumado a otro conjunto de
variables como humedad, pH, fósforo extraíble (Pe), carbono orgánico total (COT) y nitrógeno total (Nt) que fueron
determinadas a partir de las mismas muestras de suelo por
Duval y et al. (2013). El eje PC1 (explica el 64,2% de la
varianza) muestra una clara separación entre los diferentes
tratamientos, separándolos en tres grupos independientemente de la estación en la que se tomó la muestra (Fig 4).
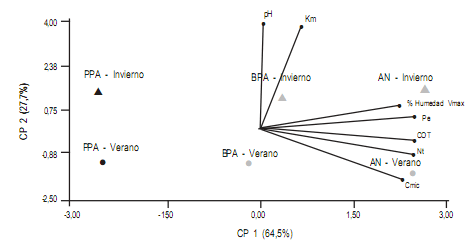
Figura 4. Análisis de componentes principales incluyendo a las variables Vmax y Km de la FME, Cmic, carbono orgánico total (COT), nitrógeno total (Nt),
fósforo extraíble (Pe), pH y humedad. Los tratamientos son ambiente natural (AN), buenas prácticas agrícolas (BPA) y pobres prácticas agrícolas (PPA).
Las líneas indican el sentido y la magnitud de la variable. Los valores de COT, Nt, Pe, pH y humedad fueron tomados de Duval et al. (2013).
Figure 4. Principal component analysis including Vmax and Km of phosphomonoesterase, Cmic, total organic carbon (COT), total nitrogen (Nt), phosphoro
extractable (Pe), pH and humidity. Lines indicate the direction and magnitude of the parameter. Circles (summer) and triangles (winter) are color-coded
to indicate the different managements: white corresponds to natural environments (AN), grey to good agricultural practices (BPA); black are Poor agricultural
practices (PPA). The values of COT, Nt, Pe, pH y humidity were taken from Duval et al. (2013).
DISCUSIÓN
La posibilidad de replicar los muestreos en diferentes
estaciones de dos años consecutivos nos permitió encontrar que la dinámica de la actividad de la FME es afectada
por la rotación de cultivos. Además, éstas medidas bajo
diferentes situaciones fueron opuestas entre los tratamientos con tendencia al monocultivo (PPA) y los de ambientes
naturales (AN). Por su parte, los suelos bajo un tratamiento con BPA mostraron un comportamiento intermedio con
mayor similitud a los AN.
En los suelos de bosques las dinámicas de la actividad
de la FME se han explicado sobre la base de una diferencia
en la humedad del suelo en las diferentes estaciones
(Grierson & Adams, 2000). En nuestro caso de estudio la
variación en la humedad de los suelos al momento de los
muestreos (Tabla 1) no muestra ninguna relación con las
variaciones encontradas en Vmax (Fig 1 y Tabla 2). Las diferencias en las dinámicas estacionales que se encontró sugieren que la explicación puede deberse a la diferencia
de intensidad en las rotaciones de cultivos en BPA respecto
a PPA. Ésta explicación se basa en que al aumentar el número
de especies que ocupan el suelo durante un tiempo determinado se ubica al tratamiento BPA en una situación intermedia entre el AN, que se encuentra siempre con varias
especies vegetales activas, y el tratamiento PPA, que presenta mayormente la misma especie.
Al igual que Wang et al. (2015) se encontró una correlación positiva entre la actividad FME y Cmic (p valor <0,02). En nuestro trabajo los valores de Vmax no alcanzan
para explicar los valores de Vmax debido a que la estimación
de actividad específica (Vmax/Cmic) no arroja un valor constante. En otras palabras, al seguir observando diferencias
entre los tratamientos se sugiere que hay aportes de FME
que no están compensados por el Cmic. Considerando que
existe una contribución mayormente bacteriana a la actividad de la FME y teniendo en cuenta que se ha mostrado
(a partir de las mismas muestras que utilizamos aquí) que
los lotes con tendencia al monocultivo de soja presentan
una menor diversidad bacteriana tipo beta por pérdida de
especies endémicas (Figuerola et al., 2014), podría
especularse que estas especies bacterianas que desaparecen son responsables de las diferencias en la actividad de
la FME. Una alternativa es que una proporción de la FME
sea aportada por los exudados radiculares, algo que ya se
ha observado con anterioridad (Nannipieri et al., 2011).
Los valores de Km no se afectaron por los manejos
agrícolas pero claramente mostraron un efecto estacional. La constante Km se considera, por aproximación, un potencial de afinidad de las FME del suelo por el sustrato utilizado
en el ensayo (MUB-fosfato), y ésta afinidad aumenta
cuando Km disminuye. Estos resultados pueden atribuirse
a: 1) las diferentes FME expresadas (isoenzimas) en diferentes condiciones de humedad, temperatura y pH determinados por los cambios estacionales, pues en el análisis
de componentes principales las variables pH y Km de las FME
se manifestaron en el eje PC2 (explica el 27,7% de la
varianza) (Fig 4), 2) la presencia de un inhibidor compe-
titivo en verano para FME, como podría llegar a ser el fosfato
utilizado como fertilizante que se adicionó al suelo en primavera con la siembra. Sin embargo, la variación en los
valores de Km también se observó en los ambientes naturales (AN) sin fertilización fosforada alguna, con lo cual la
hipótesis del inhibidor competitivo pierde peso para explicar el fenómeno estacional.
A partir del resultado del análisis de componentes
principales donde se asocian las variables con vectores se
observa que Vmax y Cmic , junto a otras variables como Nt,COT, Pe y humedad del suelo permiten diferenciar los tratamientos respecto al nivel de rotación de cultivos en suelos
bajo siembra directa.
CONCLUSIONES
La actividad de FME en suelos bajo SD medidos como Vmax permite diferenciar suelos con prácticas de manejo
sustentables con rotación de cultivos de suelos con practicas no sustentables manejados con monocultivo. Esta
diferencia es independiente del efecto estacional que se
observa en la FME de los suelos expresado en el cambio de
la Km para la FME según la estación del año. Las variaciones
en la actividad no pueden explicarse por el valor de Cmic,
sugiriendo un aporte de los cultivos a esta actividad fisiológica del suelo, lo que se podría evaluar, a futuro, en
situaciones con intensificación de la cantidad de cultivos
por rotación.
AGRADECIMIENTOS
Agradecemos a los miembros del consorcio BIOSPAS
por su participación en los muestreos.
Este trabajo fue financiado por el Ministerio de Ciencia, Tecnología e Innovación Productiva de Argentina
(ANPCYT PAE 36976 y PID53) y la Universidad Nacional
de Quilmes (PUNQ R732/11). LA Gabbarini y LG Wall son
investigadores de CONICET y JP Frene cuenta con beca
Doctoral CONICET.
BIBLIOGRAFÍA
1. AAPRESID 2014. Agricultura Certificada. http://www.aapresid.org.ar/ac/. 11/10/2016.
2. Albertengo, J; C Belloso; MB Giraudo; R Peiretti; H Permingeat & L
Wall. 2013. 15 Conservation Agriculture in Argentina. Conserv.
Agric. Glob. Prospects Chall. 352 pp.
3. Allison, B; L Condron; D Peltzer; S Richardson & B Turner. 2007. Changes
in enzyme activities and soil microbial community composition
along carbon and nutrient gradients at the Franz Josef chronosequence, New Zealand. Soil Biol. Biochem. 39: 1770-1781.
4. Brookes, P & R Joergensen. 2006. Micribial Biomass Measurements
by Fumigation Extraction. In: Bloem J., Hopkins D., & Benedetti
A. (eds), Microbiological Methods for Assessing Soil Quality, CABI
publishing, Cambridge.
5. Burns, RG; JL DeForest; J Marxsen; RL Sinsabaugh ; ME Stromberger;
MD Wallenstein; MN Weintraub & A Zoppini. 2013. Soil enzymes
in a changing environment: current knowledge and future
directions. Soil Biol. Biochem. 58: 216-234.
6. Carter, MR. 2002. Soil Quality for Sustainable Land Management:
Organic Matter and Aggregation Interactions that Maintain Soil
Functions. Agron. J. 94: 38-47.
7. Castiglioni, MG; F Behrends Kraemer; M Morras & H José. 2013. Efecto
de la secuencia de cultivos bajo siembra directa sobre la calidad
de algunos suelos de la región Pampeana. Cienc. Suelo 31: 93-105.
8. Das, N; S Sengupta & M Mukherjee M 1997. Importance of Laccase
in Vegetative Growth of Pleurotus ûorida. Appl. Environ. Microbiol.
63: 4120-4122.
9. DeForest, JL. 2009. The influence of time, storage temperature, and
substrate age on potential soil enzyme activity in acidic forest soils
using MUB-linked substrates and L-DOPA. Soil Biol. Biochem. 41:
1180-1186.
10. Deng, S & M Tabatabai. 1997. Effect of tillage and residue management
on enzyme activities in soils: III. Phosphatases and arylsulfatase. Biol Fertil Soils. 24: 141-146.
11. Derpsch, R & T Friedrich. 2009. Global overview of Conservation
Agriculture No-till adoption. 4th World Congress on Conservation
Agriculture,
12. Derpsch, R; T Friedrich; A Kassam & H Li. 2010. Current status of
adoption of no-till farming in the world and some of its main
benefits. Int J Agric Biol Eng. 3. .
13. Di Rienzo, JA; F Casanoves; MG Balzarini; L Gonzalez; M Tablada & CW Robledo. 2012. InfoStat versión 2012. Universidad Nacional
de Córdoba, Argentina., Córdoba.
14. Duval, M; J Galantini; J Iglesias; S Caneloa; M Martineza & L Wall. 2013.
Analysis of organic fractions as indicators of soil quality under
natural and cultivated systems. Soil Tillage Res. 131: 11-19.
15. Ekenler, M & M Tabatabai. 2002. b-Glucosaminidase activity of soils:
effect of cropping systems and its relationship to nitrogen
mineralization. Biol. Fertil. Soils 36: 367-376.
16. FAO. 2007. Buenas Prácticas Agrícolas. http://www.fao.org/prods/gap/home/principles_es.htm. 11/10/2016.
17. Feng, X & M Simpson. 2009. Temperature and substrate controls
on microbial phospholipid fatty acid composition during
incubation of grassland soils contrasting in organic matter quality. Soil Biol Biochem. 41: 804-812.
18. Ferrari, AE; S Ravnskov; J Larsen; T Tønnersen; RA Maronna & L Wall.
2015. Crop rotation and seasonal effects on fatty acid profiles of
neutral and phospholipids extracted from no-till agricultural soils. Soil Use Manag. 31(1):165-175.
19. Figuerola, E; L Guerrero; D Türkowsky; L Wall & L Erijman. 2014. Crop
monoculture rather than agriculture reduces the spatial turnover
of soil bacterial communities at a regional scale. Environ. Microbiol.
17(3): 678-688.
20. Figuerola, E; L Guerrero;S Rosa; L Simonetti L; M Duval; J Galantini;
JC Bedano; L Wall & L Erijman. 2012. Bacterial Indicator of
Agricultural Management for Soil under No-Till Crop Production. PLoS ONE 7: e51075.
21. Ge, G; Z Li; F Fan; G Chu; Z Hou & Y Liang. 2010. Soil biological activity
and their seasonal variations in response to long-term application
of organic and inorganic fertilizers. Plant Soil 326: 31-44.
22. German, DP; MN Weintraub; AS Grandy; CL Lauber; ZL Rinkes & SD
Allison. 2011. Optimization of hydrolytic and oxidative enzyme
methods for ecosystem studies. Soil Biol. Biochem. 43: 7e1397.
23. Gianfreda, L; M Raoa; A Piotrowskaa; G Palumbob & C Colombo. 2005.
Soil enzyme activities as affected by anthropogenic alterations:
intensive agricultural practices and organic pollution. Sci. Total
Environ. 341: 265-279.
24. Grierson, PF & MA Adams. 2000. Plant species affect acid phosphatase,
ergosterol and microbial P in a Jarrah (Eucalyptus marginata Donn
ex Sm.) forest in south-western Australia. Soil Biol. Biochem. 32:
1817-1827.
25. Klose, S; J Moore & M Tabatabai. 1999. Arylsulfatase activity of
microbial biomass in soils as affected by cropping systems. Biol.
Fertil. Soils 29: 46-54.
26. Laudicina, V; P Dennis; E Palazzolo & L Badalucco. 2012. Chapter
6: Key Biochemical Attributes to Assess Soil Ecosystem Sustainability. pp. 193-227. In: Malik A. & Grohmann E. (eds), Environmental Protection Strategies for Sustainable Development,
Strategies for Sustainability, Springer Science+Business Media.
27. Louche, J; MA Ali; B Cloutier-Hurteau; F Sauvage; H Quiquampoix & C Plassard. 2010. Efficiency of acid phosphatases secreted from
the ectomycorrhizal fungus Hebeloma cylindrosporum to hydrolyse
organic phosphorus in podzols. FEMS Microbiol. Ecol. 73: 323-335.
28. Marx, M; M Wood & S Jarvis. 2001. A microplate fluorometric assay
for the study of enzyme diversity in soils. Soil Biol. Biochem. 33:
1633-1640.
29. Moore, J; S Klose & M Tabatabai. 2000. Soil microbial biomass carbon
and nitrogen as affected by cropping systems. Biol Fertil Soils 31:
200-210.
30. Nannipieri, P; L Giagnoni; L Landi & G Renella. 2011. Role of Phosphatase
Enzymes in Soil. pp. 215-243. In: Bünemann E.K., Oberson A., & Frossard E. (eds), Phosphorus in Action, Springer Berlin Heidelberg,
Berlin.
31. Nannipieri, P; L Giagnoni; G Renella; E Puglisi; B Ceccanti; G Masciandaro; F Fornasier; MC Moscatelli & S Marinari. 2012. Soil
enzymology: classical and molecular approaches. Biol. Fertil. Soils
48: 743-762.
32. Pittelkow, CM; X Liang; BA Linquist; KJ Van Groenigen; J Lee J; ME
Lundy; N van Gestel N;J Six; RT Venterea & C van Kessel. 2015.
Productivity limits and potentials of the principles of conservation
agriculture. Nature 517: 365-368.
33. Romaniuk, R; L Giuffre; A Costantini; N Bartoloni & P Nannipieri.
2011a. A comparison of indexing methods to evaluate quality of
soils microbiological properties. Soil Res. 49: 733-741.
34. Romaniuk, R; L Giuffré; A Costantini A; N Bartoloni & P Nannipieri.
2014. A comparison of indexing methods to evaluate quality of
horticultural soils. Part II. Sensitivity of soils microbiological
indicaors. Soil Res. 52: 409-418.
35. Romaniuk, R; L Giuffre L; A Costantini & P Nannipieri. 2011b.
Assessment of soil microbial diversity measurements as indicators
of soil functioning in organic and conventional horticulture
systems. Ecol. Indic. 11: 1345-1353.
36. Vance, ED; PC Brookes & DS Jenkinson. 1987. Microbial biomass
measurements in forest soils: Determination of kC values and tests
of hypotheses to explain the failure of the chloroform fumigationincubation method in acid soils. Soil Biol. Biochem. 19: 689-696.
37. Virto, I; P Barré; A Burlot & C Chenu. 2012. Carbon input differences
as the main factor explaining the variability in soil organic C storage
in no-tilled compared to inversion tilled agrosystems. Biogeochemistry 108: 17-26.
38. Wall, L. 2011. The BIOSPAS consortium: Soil Biology and Agricultural
Production. pp. 299-306. In: de Bruijn F. (eds), Handbook of
Molecular Microbial Ecology I: Metagenomics and Complementary
Approaches, John Wiley & Sons, Inc,
39. Wang, R; M Dorodnikov; S Yang; Y Zhang; TR Filley; RF Turco; Y Zhang;
Z Xu; H Li & Y Jiang. 2015. Responses of enzymatic activities within
soil aggregates to 9-year nitrogen and water addition in a semiarid grassland. Soil Biol. Biochem. 81: 159-167.






