Table 1. Physical-chemical properties of fresh broiler litter. Content of nutrients are expressed per kg of dry matter.
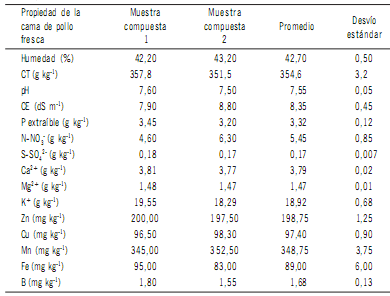
CT= carbono total, CE= conductividad eléctrica, P= fósforo extraíble con HCl 0,025 M y NH4F 0,03M (Bray 1).
FERTILIDAD DE SUELOS Y NUTRICIÓN VEGETAL
Calidad de la cama de pollo fresca y compostada
Hernán Paterlini1; María Virginia González*1 & Liliana Inés Picone1
1 Unidad Integrada Balcarce (Facultad Ciencias Agrarias, UNMdP-EEA INTA Balcarce), CC. 276, (7620) Balcarce, Argentina hparterlini@yahoo.com.ar; lastre19@yahoo.es, picone.liliana@inta.gob.ar.
*Autor de contacto: lastre19@yahoo.es
Recibido: 01-05-16
Recibido con revisiones: 16-09-16
Aceptado: 21-11-16
RESUMEN
El uso de la cama de pollo fresca como fertilizante orgánico es una práctica común en la actividad hortícola, habiéndose reportado beneficios como efectos negativos en aplicaciones a largo plazo. Una alternativa para minimizar estos últimos es aplicar el compost de la cama de pollo. En el presente estudio se evaluó las características físico-químicas de la cama de pollo fresca, así como los cambios que sufren las mismas después del proceso de compostaje. Con este fin, se dispuso de material fresco de cama de pollo con el cual se construyeron pilas de compostaje bajo dos manejos distintos: pilas estáticas y sin riego (PE), y pilas con remoción y riegos periódicos (PR). En la cama de pollo fresca como la en la proveniente de las PE y PR se determinó carbono total (CT), pH, conductividad eléctrica (CE), fósforo (PT) y nitrógeno total (NT), nitrato (NO3-), P extraíble, sulfato (SO42), Ca2+, Mg2+, K+ y elementos traza. La cama de pollo fresca se caracterizó por tener pH levemente alcalino (7,55), CE entre 7,9 y 8,8 dS m-1, alto contenido promedio de CT (354,6 g kg-1), P extraíble (3,32 g P kg-1) y NO3- (5,45 g N kg-1), y menor contenido de K+ (18,92 g kg-1). El compostaje en las PR incrementó (p<0.05) el contenido de PT (19,7 g kg-1) y Mg2+ (5,33 g kg-1) mientras que disminuyó significativamente (p<0,05) el pH (8,2) y la CE (8,87 dS m-1) en comparación con las PE. En las demás propiedades como CT, P extraíble, NT, NO3-, SO42-, Ca2+, K+, Zn, Cu, Mn, Fe y B no hubo diferencias entre ambos tipo de pilas. La maduración en las PR fue acompañada por un menor pH y CE, produciendo una mayor reducción de masa y pérdidas por lavado con respeto a las PE. El compostaje empleando la técnica de remoción y riego de las pilas sería una práctica útil para estabilizar los residuos provenientes de aves y minimizar su impacto en el medio ambiente.
Palabras clave: Abono avícola; Nutrientes; Manipuleo del abono; Caracterización física, Caracterización química.
Quality of fresh and composted broiler litter
ABSTRACT
The use of fresh broiler litter as organic fertilizer is a common practice in horticulture, despite the fact that benefits as well as negative effects on soils have been reported in long-term applications. An alternative to minimize the latter is to apply composted broiler litter. The present study, evaluated the physical-chemical characteristics of fresh broiler litter and their changes after the composting process. For this purpose two types of composting piles were constructed using fresh broiler litter: static piles without irrigation (PE), and piles with periodic removal and irrigation (PR). In the fresh broiler litter of the PE and PR treatments, total carbon (TC), pH, electrical conductivity (EC), total phosphorus (TP) and nitrogen (TN), nitrate (NO3-), extractable P, sulfate (SO42-), Ca2+, Mg2+, K+ and trace elements were determined. Fresh broiler litter was slightly alkaline (pH 7,55), EC ranged between 7,9 and 8,8 dS m-1, average concentrations of TC (354,6 g kg-1), extractable P (3,32 g P kg-1) and NO3- (5,45 g N kg-1) were high while K+ concentration was lower (18,92 g kg-1). Composted broiler litter in PR had greater (p<0.05) TP content (19,7 g kg-1) and Mg2+ (5,33 g kg-1) while pH (8,2) and EC (8,87 dS m-1) decreased compared to PE. Total C, extractable P, TN, NO3-, SO42-, Ca2+, K+, Zn, Cu, Mn, Fe and B showed no differences between both pile types. The maturation of PR was accompanied by a decline of pH and EC, resulting in a greater mass reduction and losses by leaching with respect to the PE. Composting, using the technique of removal and irrigation could be a useful practice to stabilize poultry waste and minimize its environmental impact.
Key words: Poultry manure; Nutrients; Handling manure; Physical characterization; Chemical characterization.
INTRODUCCIÓN
A nivel mundial, el sector hortícola se ubica en segundo
lugar de importancia en la actividad agrícola con un volumen de producción que no supera al 40% de la producción
de cereales (Fernández Lozano, 2012). En la Argentina se
estima que la producción anual de hortalizas es de aproximadamente 8 a 10 millones de toneladas, ocupando una
superficie de 450 a 500.000 hectáreas (Fernández Lozano,
2012). La producción de hortalizas es la actividad agrícola
que demanda mayor cantidad de abonos orgánicos, siendo
la cama de pollo o de gallina los más usados, los cuales
provienen de una importante actividad avícola llevada a
cabo en las proximidades a los campos de aplicación.
Aproximadamente, se generan en la Argentina 3.600.000
toneladas por año de excreta de pollo, las cuales se distribuyen mayoritariamente en las provincias de Buenos Aires
y Entre Ríos (Ministerio de Agroindustria. Secretaría de
Agricultura, Ganadería y Pesca, 2015).
La producción avícola intensiva produce desperdicios
que tienen alto contenido de nutrientes y compuestos
orgánicos los cuales pueden generar contaminación del
suelo y de los cursos de aguas, emitir olores desagradables
y alta concentración de gases como amoníaco (NH3),
además de propiciar la proliferación de vectores y microorganismos patógenos, lo cual tiene un impacto negativo
en el medio ambiente (Estrada Pareja, 2005). Bitzer & Sims
(1988) informaron que la aplicación excesiva de abono
avícola puede causar la contaminación de las aguas subterráneas por nitrato, especialmente en suelos de textura
más gruesa. Sharpley et al. (1998) indicaron que la aplicación a largo plazo de cama de pollo podría afectar negativamente la productividad y la calidad del suelo al crear un
potencial desbalance de nutrientes. La utilización de residuos orgánicos frescos presenta también, otros inconvenientes como la presencia de residuos de pesticidas y de
fármacos como antibióticos, larvicidas y coccidiostáticos
(Bolan et al., 2010), y la posibilidad de causar fitoxicidad
debido a las altas concentraciones de metales pesados,
particularmente Cu y Zn (Cheung & Wong, 1983), y de sales
(Tam & Tiquia, 1993; Tiquia & Tam, 2000). Una alternativa para reducir el impacto ambiental de los abonos orgánicos, y a la vez permitir su utilización en la agricultura es
el tratamiento de los mismos a través del compostaje. Éste
es un proceso biológico aeróbico que ocurre como consecuencia de la actividad de los microorganismos que se
encuentran naturalmente en los desechos los cuales transforman la materia orgánica biodegradable en productos
estables similares al humus. La efectividad del proceso de compostaje depende de diversos factores como temperatura, suministro de oxígeno, contenido de humedad, pH,
relación carbono/nitrógeno (C/N), tamaño de partícula y
grado de compactación (Imbeah, 1998), los cuales pueden
ser controlados en mayor o en menor medida dependiendo del tipo de almacenaje y manipulación de los desechos.
Para que el proceso ocurra correctamente se debe contar
con un material inicial que tenga una relación C/N entre
20:1 y 40:1, mantener el porcentaje de humedad entre 50
y 65% y lograr un mínimo de concentración de oxígeno
mediante la aireación con distintos métodos (Walker,
2010). Dicho proceso destruye patógenos e inactivas semillas de malezas, reduce el volumen de los desechos haciéndolos más fácil de manipular y transportar (Imbeah,
1998), y convierte el N a formas orgánicas estables como
el acido húmico (Eneji et al., 2001). El compostaje produce
humus el cual puede usarse como fuente de material orgánico, y a su vez libera nutrientes vía mineralización más
lentamente que el material fresco (Preusch et al., 2002),
disminuyendo con ello el riesgo de contaminación ambiental. Bajo condiciones de riego, con aplicaciones repetidas
anuales, particularmente en dosis altas, de abono animal
fresco cantidades apreciables de N pueden perderse por
lavado y volatilización (Chang & Janzen, 1996). Además
del suministro de macro y micro nutrientes, la aplicación
de enmiendas orgánicas mejora las características del suelo,
generando aumento del contenido de materia orgánica y
de la porosidad total, disminución de la densidad aparente,
mejor infiltración del agua y mayor estabilidad de los agregados (Seguel et al., 2003), como así también un incremento en la población microbiana y en la actividad enzimática
(Lee et al., 2004). No obstante estos beneficios, hay ciertas
desventajas del compostaje como son las pérdidas gaseosas
de N bajo las formas de NH3, óxido nitroso, óxido nítrico,
y posiblemente otros compuestos como NOx (Martins & Dewes, 1992; Czepiel et al., 1996; Körner et al., 1999), y
por lavado de N y otros nutrientes presentes en el compost,
dependiendo de las condiciones de lluvia. Eghball et al.
(1997) encontraron que durante el compostaje se pierde
19 a 42% del N, en su mayoría por volatilización, y 46 a
62% del C principalmente vía oxidación. Otras desventajas incluyen el tiempo requerido para la obtención del producto estabilizado (Ogunwande et al., 2008), los posibles
olores asociados a dicho proceso (Walker, 1993), y el equipamiento y la mano de obra para las labores (Lynch & Cherry, 1996). En base a lo anteriormente expuesto, se deduce
que es crucial conocer la composición de la cama de pollo
con el fin de realizar un manejo apropiado de nutrientes al usar los abonos orgánicos como potenciales fertilizantes en los suelos.
Los objetivos de este estudio fueron evaluar I) las
características físico-químicas de la cama de pollo fresca,
retirada de los galpones, y II) los cambios que sufren las
mismas, después del proceso de compostaje de la cama de
pollo en pilas sometidas a distintos manejos.
MATERIALES Y MÉTODOS
El ensayo se llevó a cabo, entre los meses de octubre 2012
y enero 2013, en un lote de la Unidad Integrada Balcarce, Estación Experimental Agropecuaria INTA Balcarce - Facultad de
Ciencias Agrarias, UNMdP (37º45’13’’S, 58º17’53’’W; 136 m
snm), provincia de Buenos Aires. En este ensayo se utilizó cama
de pollo parrillero, proveniente de un establecimiento avícola
ubicado en la zona, la cual se descargó en el sitio experimental
el 12 de octubre 2012. Luego de realizarse la descarga del abono,
se tomaron dos muestras compuestas siguiendo las indicaciones de Lavergne (2002). Para realizar este muestreo se eligieron doce puntos, al azar y bien dispersos, en la pila de abono
fresco. En cada uno de estos puntos y a distintas profundidades, se extrajeron cinco muestras mediante una pala que se colocaron sobre una bolsa de polietileno, se mezclaron, y luego
se tomó una muestra (aproximadamente 1-2 kg) que se colocó en un balde limpio de 20 L. Una vez depositadas las doce muestras
de abono dentro del balde, el material se homogeneizó nuevamente, y de esta mezcla se extrajo una muestra de aproximadamente 1-2 kg que representó la muestra compuesta final. Este
muestreo se repitió para obtener la segunda muestra compuesta de abono fresco. Inmediatamente luego de ser extraídas, las
muestras se enviaron a un laboratorio privado para su caracterización. En ellas se realizaron los siguientes análisis físico-químicos: humedad por gravimetría, secando la muestra a 105 oC,
hasta alcanzar peso constante, por al menos 24 horas, hasta
alcanzar peso constante; carbono total (CT) por combustión
húmeda con dicromato de potasio y ácido sulfúrico (Walkey & Black, 1934); nitrato (NO3-) mediante un electrodo específico para nitrato; fósforo (P) extraíble mediante HCl 0,025
M y NH4F 0,03M (Bray & Kurtz, 1945), y posteriormente por
colorimetría utilizando el método del molibdato-ácido ascórbico (Murphy & Riley, 1962); sulfato (SO42-) por el método turbidimétrico; cationes como calcio (Ca2+), magnesio (Mg2+) y
potasio (K+) por extracción con acetato de amonio 1N (Chapman, 1965); micronutrientes como cinc (Zn), hierro (Fe), cobre
(Cu) y manganeso (Mn) por extracción con pentaacetato de
dietilentriamina (DTPA) (Lindsay & Norvell, 1978) y posterior
cuantificación por espectrofotometría de absorción atómica;
boro (B) por espectrofotometría de absorción con curcumina;
pH por el método potenciométrico en una suspensión acuosa con una relación abono:agua de 1:2,5; y conductividad eléctrica (CE) en el extracto saturado del abono mediante un conductímetro.. .. .
Con la cama de pollo depositada sobre la superficie del suelo,
libre de vegetación y sin remover, se armaron seis pilas de sección
triangular, cuyas dimensiones fueron 2,20 m de largo, 1,80 m
de ancho y 0,75 m de alto. A tres pilas, denominadas pilas removidas (PR), se les realizaron nueve remociones y ocho riegos
periódicos con el objetivo de mantener el contenido de humedad dentro del rango óptimo, entre 50 y 65%. Las otras tres pilas,
denominadas pilas estáticas (PE), sólo fueron sometidas a una
remoción a los 52 días de iniciado el período de almacenaje y
no fueron regadas. Las pilas permanecieron expuestas al aire
libre, y durante el período de almacenaje llovieron en total 452
mm. Las remociones en las pilas se hicieron periódicamente
empleando una pala manual con el fin de favorecer la homogenización del material, la incorporación de oxígeno, la redistribución de los microorganismos y la exposición de nuevas superficies para facilitar la degradación de la materia orgánica.
La determinación del contenido de humedad de las pilas, con
el fin de establecer el momento y la cantidad de riegos, se realizó siguiendo el método descripto por Rynk et al. (1992). Según este
procedimiento, si el material está sobresaturado con agua al
apretarlo con la mano se extrae el agua fácilmente, de lo contrario el material está cerca del contenido ideal de humedad.
A los 104 días de construcción de las pilas, se consideró que se había obtenido un producto estable y maduro, y que
había terminado el proceso de compostaje. Para ello se tuvo
en cuenta, las características macroscópicas de las pilas como
son el grado de degradación del material y desarrollo de olores,
conjuntamente con la temperatura que se estabilizó en 30-33 oC, después de la fase termofílica y durante aproximadamente 30 días, a pesar de los riegos y lluvias periódicas registradas (datos no mostrados). En el compostaje se cumplieron
con los tiempos y temperaturas para la reducción de patógenos.
En este momento, se tomó una muestra compuesta en cada
una de las pilas y se enviaron al laboratorio privado para realizar
los mismos análisis que la cama de pollo fresca, pero se agregó la determinación de N total (Nt) mediante digestión y luego
destilación empleando el método micro-Kjeldahl (Bremner& Mulvaney, 1982), y P total (Pt) por digestión con ácido nítrico
concentrado y ácido perclórico (Jackson, 1970). En las PR y PE,
la muestra compuesta se conformó de la misma manera que
la obtenida al inicio del ensayo, siguiendo el procedimiento descripto por Lavergne (2002).
Se analizaron los resultados de las distintas propiedades físico-químicas del compostaje en las PR y PE mediante la realización de un test t de Student para dos muestras independientes (p<0,05). El análisis estadístico se efectuó empleando el software libre R.
RESULTADOS Y DISCUSIÓN
Características físico-químicas de la cama
de pollo fresca
En la Tabla 1 se muestran los análisis físico-químicos
de la cama de pollo fresca, en cada una de las dos muestras
compuestas, como así también el valor promedio y el desvío
estándar.
La cama de pollo está compuesta principalmente por
excretas, plumas, material para la cama y restos de alimentación (Tasistro et al., 2004). Numerosos investigadores
han documentado que la cama de pollo es una fuente valiosa de nutrientes esenciales para las plantas como N, P
y K, de secundarios como Ca2+, Mg2+ y azufre (S), y de elementos traza como Cu, Zn, Fe, Mn, cobalto (Co), yodo (I)
y molibdeno (Mo), además de contener residuos de pesticidas y fármacos, y de microorganismos (Harmel et al.,
2009; Bolan et al., 2010; Reiter et al., 2014). En este tipo
de abono, como sucede con otros residuos orgánicos, el
contenido de humedad, el pH, el nivel de sales solubles y
la composición elemental varían ampliamente en función
del tipo de ave de corral, dieta, suplementos en la alimentación, tipo y cantidad de material usado como cama, y manejo y condiciones de almacenamiento del material,
entre otros factores. Esta alta variabilidad en la composición física y química de la cama de pollo (Patterson et al.,
1998; Nahm, 2003) marca la importancia del método de
muestreo ya que determina lo representativa que es la
muestra del abono orgánico.
Tabla 1. Propiedades físico-químicas de la cama de pollo fresca. Contenido de nutrientes expresado
por kg de materia seca.
Table 1. Physical-chemical properties of fresh broiler litter. Content of nutrients are expressed per
kg of dry matter.

CT= carbono total, CE= conductividad eléctrica, P= fósforo extraíble con HCl 0,025 M y NH4F 0,03M (Bray 1).
En este estudio el contenido promedio de humedad de
la cama de pollo fresca fue de 42,7% (Tabla 1). Este valor
se mantuvo dentro de los valores considerados óptimos
para iniciar el proceso de compostaje, entre 40 y 65%, ya
que niveles más altos de humedad limitan la difusión del
oxígeno (Rynk et al. 1992) y aumentan la volatilización
de NH3 debido, en parte a un incremento en la mineralización de N y a una incrementada disolución del amonio
presente en la cama de pollo (Cabrera & Chiang, 1994).
El pH es una propiedad importante a considerar ya que
condiciona la presencia de microorganismos y afecta la
liberación de N como NH3. Los valores de pH obtenidos de
7,5 y 7,6 (Tabla 1) concuerdan con los reportados por Rieraet al. (2014) para cama de pollo parrillero, y están incluidos
dentro del rango que generalmente se encuentra en la cama de pollo, el cual fluctúa entre 7 y 8,5. Valores de pH mayores pueden inducir al proceso de volatilización, incrementado los niveles de NH3 en la atmósfera en perjuicio
de la salud de las aves y personas (Carlile, 1984). Si bien
como enmienda tiene efecto alcalino, al momento de aplicarla hay que considerar la capacidad buffer del suelo o bien
corregir la enmienda con el agregado de agentes acidificantes como el sulfato ferroso o de aluminio que decrecen
marcadamente el potencial de volatilización de NH3 (Moore et al., 1995) ya que las pérdidas por NH3 son mínimas a pH
menor de 7. Al igual que el pH, la CE es otra propiedad relacionada con la calidad del abono que indirectamente indica la concentración de sales solubles presentes en el mismo. Los niveles de CE de 7,9 y 8,8 dS m-1 (Tabla 1) están
comprendidos dentro del rango de 7,6 a 11,6 dS m-1 reportado por Turnell et al. (2006) para cama de pollo proveniente de galpones bajo diferentes manejos. El pH ligeramente
alcalino y la elevada CE se deben a la importante cantidad
de ácido úrico que poseen las heces, el cual libera amoníaco formando compuestos amoniacales, y en menor
proporción NO3. La alta concentración de sales en la cama
de pollo limitaría su valor comercial para ser utilizada como
enmienda orgánica dado que se incrementaría el riesgo de
salinización, afectando la disponibilidad de agua para las
plantas en el suelo donde se aplica. Por ello es necesario
analizar la cantidad y la frecuencia con la que se aplica este
abono orgánico; involucrando en este análisis las características físico-químicas del suelo. El contenido promedio
de CT fue de 354,6 g kg-1, el cual es similar al valor de 344
g kg-1 obtenido para cama de pollo por Sistani et al. (2008),
y está dentro del rango entre 295,8 y 429,8 g kg-1 reportado por Qafoku et al. (2001) al analizar sesenta muestras
de cama de pollo.
Este tipo de abono aporta nutrientes esenciales para
el crecimiento de las plantas, entre ellos se destaca el P donde los niveles de P extraíble Bray 1 fueron muy elevados,
alcanzando valores de hasta 3,45 g P kg-1 (Tabla 1). Codlinget al. (2008) encontraron concentraciones extremadamente altas de P-Bray 1, hasta 13,4 g P kg-1 en cama de pollo. Las variaciones en los valores de P-Bray 1 entre muestras podrían deberse al tipo de material usado para realizar
la cama (Carpenter, 1992). El material comúnmente usado es aserrín o astillas de madera el cual puede reaccionar
con el P durante el período de almacenaje y reducir la cantidad de P extraíble. Al aplicar un abono, continuamente
y con altas concentraciones de P extraíble que excedan la
tasa de remoción por parte del cultivo, se incrementaría
la concentración de P en el suelo (Maguire & Sims, 2002),
y en la medida que la capacidad de adsorción de P por los
sólidos del suelo es saturada se corre el riesgo ambiental de contaminación de los cuerpos de agua por escorrentía
o lavado del P (Maguire & Sims, 2002; Moore & Edwards,
2007). La cama de pollo también, se caracterizó por tener
una concentración muy alta de N inorgánico como NO3-,
promedio 5,45 g N kg-1 (Tabla 1). A partir del momento de
deposición de las excretas, mientras están expuestas, el N
orgánico es biodegradado generando iones amonio los cuales a su vez pueden ser oxidados biológicamente, bajo condiciones aeróbicas, a NO3-. Sharpley et al. (2009) reportaron valores de NO3- máximos
de 8,87 g N kg-1 y mínimos
de 0,057 g N kg-1, dependiendo de las condiciones ambientales que afectan la tasa de descomposición de la cama de
pollo. La concentración de los compuestos de N cambia constantemente en función de la actividad microbiana y de las
variaciones en temperatura, humedad, pH y concentración
de oxígeno (Kelleher et al., 2002). Otro de los aniones que
se detectó pero en menor concentración que el NO3- y P,
fue SO42- que promedió 0,18 g S kg-1 (Tabla 1). Entre los
cationes analizados, K+ se encontró en mayor concentración seguido por Ca2+ y por último Mg2+ (Tabla1). Los valores de Ca2+ fueron muy inferiores a los niveles de 23,4
y 26,2 g kg-1 encontrados en cama de pollo por Adeli et al. (2010) y Sistani et al. (2003); respectivamente. Los mayores contenidos de Ca2+ posiblemente se debieron a una
alimentación suplementada con este elemento, el cual es
fundamental en la dieta de las aves, y es recomendado como
complemento. Con respecto a las concentraciones de Mg2+,éstas fueron ligeramente inferiores a los valores de 4,9 y
6,1 g kg-1 reportados para cama de pollo por Adeli et al. (2010) y Sistani et al. (2003); respectivamente, mientras
que las de K+ estuvieron dentro del rango de 19,4 y 27,9
g kg-1 informado por Adeli et al. (2010).
Metales como Zn, Cu, Mn e Fe se detectaron en la cama
de pollo como derivados de la dieta ingerida. Los elementos Cu y Zn son comúnmente agregados al alimento, como parte de una dieta para optimizar el crecimiento y la performance de las aves (Rutherford et al., 2003). En algunos
casos, los elementos traza ingeridos con la alimentación
se agregan en exceso a las necesidades de las aves siendo
excretados con el estiércol que al igual que el alimento derramado y los restos de químicos usados para tratar el residuo orgánico, son factores que afectan su concentración
en la cama de pollo (Kpomblekou-A et al., 2002). La concentración promedio de Zn, Cu, y Mn fue de 198,75; 97,4
y 348,75 mg kg-1; respectivamente (Tabla 1). Estos niveles
de Zn y Cu fueron inferiores a los valores promedio de 350
mg kg-1 para Zn y 332 mg kg-1 para Cu mientras que los de
Mn se aproximaron a los 334 mg kg-1 reportados por Codling et al. (2008) para cama de pollo. Con respecto al Fe,
las concentraciones fueron muy inferiores a los valores
reportados por otros estudios que mostraron concentraciones desde 718 a 6691 mg kg-1 luego de analizar treinta
y tres camas de pollo (Kpomblekou-A et al., 2002), y de
1055 mg kg-1 (Sistani et al., 2003). La cama de pollo puede
presentar otros elementos como B (Tabla 1). El B proviene del material usado como sustrato en los criaderos; notándose un valor tan alto como 290 a 390 mg kg-1 cuando se
usa papel reciclado en la cama de pollo en comparación con
8 a 15 mg kg-1 en cama de pollo mezclada con virutas de
madera (Wilkinson, 1997). En nuestro caso al usar virutas
de madera se obtuvieron bajos valores de B, promedio 1,68
mg kg-1.
Características físico-químicas de la cama
de pollo compostada
En la Tabla 2 se presentan los valores promedio conjuntamente con los desvíos estándar de las propiedades físico-químicas de la cama de pollo en las PR y PE, luego
de 104 días de compostaje.
Tabla 2. Resultados del test t mostrando el efecto de las pilas removidas y regadas (PR), y de las
pilas estáticas, sin remover (PE) sobre las propiedades físico-químicas de la cama de pollo al final
del compostaje (104 días). Contenido de nutrientes expresado por kg de materia seca.
Table 2. Results of t-test showing the effect of removed and watered piles (PR), and static, without
removing piles (PE) on the physical-chemical properties of the broiler litter at the end of composting
(104 days). Nutrient content are expressed per kg of dry matter.
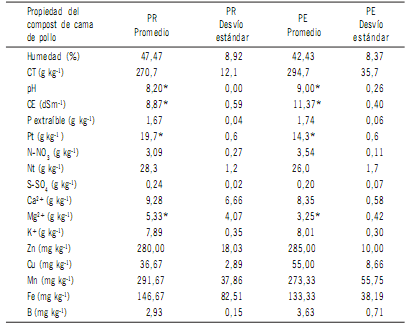
CT= carbono total, CE= conductividad eléctrica, P =fósforo extraíble con HCl 0,025 M y NH4F 0,03M (Bray 1),
Nt= nitrógeno total, Pt= fósforo total.
* Indica diferencias significativas (p<0,05) entre las PR y PE. ± Desvío estándar.
El análisis estadístico solamente mostró diferencias
significativas (p<0,05) en pH, CE, Pt y Mg2+ del compost
entre las PR y las PE (Tabla 2). Las pilas de compostaje PR
y PE presentaron valores de pH alcalino, siendo significativamente distintos, promedio 8,2 para PR y 9 para PE
(Tabla 2). Según Rynk et al. (1992), el pH durante el proceso de compostaje sigue una evolución en la que se identifican tres etapas. Una primera etapa muy corta, en la cual
el pH disminuye debido a la liberación temprana de ácidos
orgánicos, una segunda etapa en la cual el material se
alcaliniza como resultado de la producción de NH3 a partir
de compuestos nitrogenados, y una tercera etapa en la que
el pH disminuye hasta alcanzar valores cercanos a la neutralidad debido a la formación de ácidos húmicos. Siguiendo esta dinámica del compostaje, parecería que las PR estaban en un estado más avanzado de descomposición y madurez. Durante la maduración del compost, la mayoría
de la nitrificación ocurre (Bernal et al., 2009), y las pérdidas por lavado de NO3- son relevantes ya que este anión
es muy móvil y soluble (Parkinson et al., 2004). Esto se evidenció en que la CE fue significativamente inferior
(p<0,05) en las PR con respecto a las PE (Tabla 2), en concordancia con un menor pH, como resultado de un mayor
lavado de sales ya que recibieron nueve riegos distribuidos
durante el período de almacenaje, además de las precipitaciones, conjuntamente con la remoción periódica que
permitió una adecuada aireación para el proceso de compostaje. No obstante, ambos tipos de pilas presentaron una
relación C/N menor de 12, criterio requerido para alcanzar
la madurez (Bernal et al., 1998).
Con respecto al CT, no se manifestaron diferencias
(p>0,05) entre las pilas (Tabla 2). No obstante, al comparar con la cama de pollo fresca se observó que en ambos
tipos de pilas el contenido de CT tendió a disminuir después del compostaje, siendo máxima la disminución en las
PR, de 24%. Este resultado era de esperar si se entiende que
el compostaje es un proceso bioquímico mediante el cual
C y N son mineralizados y liberados en forma gaseosa a la
atmósfera como dióxido de C, NH3, óxido nitroso y N
elemental. Las condiciones apropiadas de humedad del
abono (42,7%) favorecieron la mineralización del C y N.
El contenido de humedad es muy importante porque sostiene la actividad microbiana, y por lo tanto la producción
de la enzima ureasa la cual degrada el acido úrico a compuestos nitrogenados más simples (Gordillo & Cabrera,
1997).
El Pt es otra de las propiedades químicas que mostró diferencias significativas (p<0,05) entre los dos tipos de pilas (Tabla 2). Al final del período de almacenaje las dimensiones promedio de las PR fueron 1,83 m de largo, 1,30
m de ancho y 0,53 de alto mientras que las de las PE fueron
1,98 m de largo, 1,43 de ancho y 0,58 de alto. El menor
tamaño en las PR sería consecuencia de las continuas remociones que promovieron una mayor actividad microbiana, con tasas más altas de mineralización que generaron una mayor pérdida de C como dióxido de C. Por consiguiente, se redujo la masa y el volumen del material, de
modo que produjo un material con minerales más concentrados y una concentración mayor (p<0,05) de Pt. Según Thompson et al. (2001), la remoción de las pilas durante el compostaje generó una reducción del 39 y 37%
en peso y en volumen del abono; respectivamente. DeLaune et al. (2000) mostraron que el contenido de Pt en la cama de pollo compostada incrementó en promedio 44%.
Los valores de Pt obtenidos en este estudio (Tabla 2) fueron superiores al promedio de 9,03 g kg-1, con un rango
de 6,4 y 12, 2 g kg-1, obtenido por Sharpley & Moyer (2000)
pero cercanos al valor de 15,7 g kg-1 reportado por Sikora & Enriki (2005). Estas diferencias en la concentración de
Pt en el compost entre estudios pueden deberse a diferencias en la cantidad de P en la alimentación de las aves
y al tipo de sustrato empleado en la cama de pollo el cual
puede reaccionar con el P del abono o aportar P. En cuanto
al P extraíble Bray-1, no se detectaron diferencias estadísticamente significativas (p>0,05) entre las PR y PE (Tabla
2). No obstante, los valores de P extraíble en la cama de
pollo fresca duplicaron a aquellos obtenidos luego del
compostaje pudiéndose atribuir este resultado a un mayor
lavado de las formas mineralizadas /inorgánicas de P o bien
a que el P lábil pasó a formas más estables durante el
compostaje. Se demostró que las formas de P inorgánico,
como el P soluble en HCl, aumentaron mientras que el P
soluble en agua disminuyó con el tiempo de compostaje
(Traore et al., 1999; Eneji et al., 2003a), sugiriendo estos
resultados una posible transformación del P extraíble con
agua a formas más estables o menos lábiles.
Como se observa en la Tabla 2, no hubo diferencias
(p>0,05) en la concentración de NO3- entre las distintas
pilas; sin embargo tendió a ser menor si se compara con
aquella obtenida en la cama de pollo fresca que presentó un valor máximo de 6,30 g N kg-1 (Tabla 1). Varios estudios
demostraron que la cama de pollo fresca tiene una tasa
mayor de mineralización de N que el compost (Gagnon et
al., 1998; Hartz et al., 2000) debido a que posee compuestos orgánicos nitrogenados menos estables que el N incorporado en la fracción orgánica del compost (Broadbent,
1986). El SO42- es otro de los aniones presente en el producto final del compostaje de la cama de pollo, aunque en
cantidades muy inferiores que el NO3- (Tabla 2). Con
respecto al contenido de Nt, al igual que con la concentración de NO3-, tampoco se detectaron diferencias significativas (p>0,05) en el compost entre PR y PE (Tabla 2).
De los distintos iones analizados, Mg2+ fue el único que
mostró diferencias significativas (p<0,05) entre las PR y las
PE, siendo su concentración superior en las PR (Tabla 2).
Sin embargo, al comparar la cama de pollo compostada con
la fresca se observó la tendencia de menores contenidos
de K+ en el compost lo cual puede atribuirse a la formación
de complejos insolubles en presencia de compuestos orgánicos o a cambios en el pH durante el compostaje (Irshad et al., 2013). Los metales Zn, Cu, Mn e Fe no fueron afectados (p>0,05) por el tipo de pila construida para el compostaje (Tabla 2). Las concentraciones de Cu (36,67-55,0
mg kg-1) y de Zn (280,0-285,0 mg kg-1) fueron inferiores
a 596-759 y 568-907mg kg-1 para Cu y Zn; respectivamente, informados por DeLaune & Moore (2016). No obstante, al comparar con la cama de pollo fresca la concentración de Fe y Zn tendieron a ser mayores en el compost.
Este aumento de Fe se da especialmente, bajo condiciones
anaeróbicas durante el compostaje (Eneji et al., 2003b)
mientras que el aumento del Zn se debería a la retención
del Zn soluble mediante la formación de quelatos con la
materia orgánica (Tiquia & Tam, 2002).
CONCLUSIONES
La cama de pollo se caracterizó por tener un contenido de humedad de 42,70%, óptimo para favorecer el proceso de compostaje, un pH levemente alcalino, y valores altos de NO3- (máximo 5,45 g N Kg-1), de P extraíble (máximo 3,32 g P kg-1) y de CE (8,35 dSm-1). El alto pH conjuntamente con la alta CE generó un material de menor valor comercial ya que puede producir alcalinidad y aumento de la concentración de sales en el suelo, afectando la disponibilidad de agua. A su vez, si no se maneja la aplicación de la cama de pollo fresca siguiendo las buenas prácticas de manejo, dada la alta concentración de NO3- y P extraíble se corre el potencial riesgo de que estos aniones se muevan hacia los cuerpos de agua. El compost de la cama de pollo es una alternativa ya que los niveles de CT, NO3- y P extraíble tendieron a disminuir; sin embargo el tipo de manejo de las pilas de abono afectó las características del producto final del compostaje. La remoción y el riego periódico en las PR ocasionaron una disminución del 24% en el contenido de CT respecto del material original, un proceso de humificación más avanzado y maduro evidenciado por un menor pH, una menor CE resultado del lavado de sales y un mayor contenido de Pt por pérdida de masa y volumen en relación a las PE. Por lo tanto, el proceso de compostaje usando la técnica de remoción y riego de las pilas sería una práctica útil para estabilizar los residuos provenientes de aves y minimizar su posible impacto en el medio ambiente, de manera que las cantidades de compost a aplicar y las frecuencias se planifiquen en relación a las características del suelo, su manejo y los niveles de extracción del o los sucesivos cultivos.
AGRADECIMIENTOS
Este trabajo fue financiado en el marco del Proyecto de Investigación denominado Optimización de estrategias sustentables para el manejo de producciones hortícolas de la provincia de Bs. As. (INTA-AUDEAS).
BIBLIOGRAFÍA
1. Adeli, A; H Tewolde; K Sistani & D Rowe. 2010. Comparison of broiler litter and commercial fertilizer at equivalent N rates on soil properties.Commu. Soil Sci.Plant Anal. 41: 2432-2447.
2. Bernal, MP; C Paredes; MA Sánchez-Monedero & J Cegarra. 1998. Maturity and stability parameters of composts prepared with a wide range of organic wastes. Bioresour. Technol. 63: 91-99.
3. Bernal, MP; JA Alburquerque & R Moral. 2009. Composting of animal manures and chemical criteria for compost maturity assessment. A review. Bioresour. Technol. 100: 5444-5453.
4. Bitzer, CC & JT Sims.1988. Estimating the availability of nitrogen in poultry manure through laboratory and field studies. J. Environ. Qual. 17: 47-54.
5. Bolan, NS; AA Szogi; T Chuasavathi; B Seshadri; MJ Rothrock Jr. & P Panneerselvam. 2010. Uses and management of poultry litter. World’s Poult. Sci. J. 66: 673-698.
6. Bray, RH & LT Kurtz.1945. Determination of total, organic and available forms of phosphorus in soils. Soil Sci. 59: 39-45.
7. Bremner, JM & CS Mulvaney. 1982. Nitrogen total. pp. 595-624. In: AL Page; RH Miller & DR Keeney (eds). Methods of soil analysis. 2nd ed. Agronomy series Nº9.ASA, SSSA, Madison, WI.
8. Broadbent, FE. 1986. Effects of organic matter on nitrogen and phosphorus supply to plants. pp. 13-27. In: Y Chen & Y Avnimeiech (eds). The role of organic matter in modern agriculture. Martinus Nijhof Publ., Dordrecht, Netherlands.
9. Cabrera, ML & S Chiang. 1994. Water content effect on denitrification and ammonia volatilization in poultry litter. Soil Sci. Soc. Am. J. 58: 811-816.
10. Carlile, FS. 1984. Ammonia in poultry houses. A literature review. World‘s Poult. Sci. J. 40: 99-113.
11. Carpenter, GH. 1992. Current litter practices and future needs. Proceedings of the National Poultry Waste Management, Symposium 268-273. Birmingham: Auburn University.
12. Chang, C & HH Janzen. 1996. Long-term fate of nitrogen from annual feedlot manure applications. J. Environ. Qual. 25: 785-790.
13. Chapman, HD. 1965. Cation exchange capacity. pp. 891-901. In: C Black (ed). Methods of soil analysis.Part 2.Agronomy series Nº9.ASA, SSSA, Madison, WI.
14. Cheung, YH & MH Wong. 1983. Utilization of animal manure and sewage sludge for growing vegetables. Agric. Wastes 5: 63-81.
15. Codling, EE; RL Chaney; L Charles & CL Mulchi. 2008. Effects of broiler litter management practices on phosphorus, copper, zinc, manganese, and arsenic concentrations in Maryland Coastal Plain soils. Commu. Soil Sci. Plant Anal. 39: 1193-1205.
16. Czepiel, P; E Douglas; R Harriss & P Call.1996. Measurements of N2O from composted organic wastes. Environ. Sci. Technol. 30: 2519-2525.
17. DeLaune, PB; PA Moore Jr.; TC Daniel; DR Edwards; JL Lemunyon & P Fredericks. 2000. Effects of chemical and microbial amendments on ammonia volatilization from poultry litter. USDA-ARS, Poultry Prod. and Product Safety Res. Unit, Fayetteville, AK.
18. DeLaune, PB & PA Moore, Jr. 2016.Copper and zinc runoff from land application of composted poultry litter. J. Environ. Qual. doi: 10.2134/jeq2015.09.0499.
19. Eghball, B; JF Power; JE Gilley & JW Doran. 1997. Nutrient, carbon, and mass loss during composting of beef cattle feedlot manure. J. Environ. Qual. 26: 189-193.
20. Eneji, AE; S Yamamoto; T Honna & A Ishiguro. 2001. Physicochemical changes in livestock feces during composting. Commun. Soil Sci. Plant Anal. 32: 477-489.
21. Eneji, AE; T Honna; S Yamamoto; T Masuda & M Irshad. 2003a. Changes in humic substances and phosphorus fractions during composting. Commun. Soil Sci. Plant Anal. 34: 2303-2314.
22. Eneji, AE; T Honna; S Yamamoto; T Masuda; T Endo & M Irshad. 2003b. The Relationship between total and available heavy metals in composted manure. J. Sust. Agric. 23: 125-134.
23. Estrada Pareja, MM. 2005. Manejo y procesamiento de la gallinaza. Revista Lasallista de Investigación 2: 43-48.
24. Fernández Lozano, J. 2012. Producción de hortalizas en la Argentina. Secretaria de Comercio Interior Corporación del Mercado Central de Bs.As. Gerencia de Calidad y Tecnología 29 p.
25. Gagnon, B; RR Simard; M Goulet; R Robitaille & R Rioux. 1998. Soil nitrogen and moisture as influenced by composts and inorganic fertilizer rate. Can. J. Soil Sci. 78: 207-215.
26. Gordillo, RM & ML Cabrera. 1997. Mineralizable nitrogen in broiler litter. I. Effect of litter chemical characteristics. J. Environ. Qual. 26: 1672-1679.
27. Harmel, RD; DR Smith; RL Haney & M Dozier. 2009. Nitrogen and phosphorus runoff from cropland and pasture fields fertilized with poultry litter. Journal of Soil and Water Conservation 64: 400-412.
28. Hartz, TK; JP Mitchell & C Giannini. 2000. Nitrogen and carbon mineralization dynamics of manures and composts. Hort. Science 35: 209-212.
29. Imbeah, M. 1998. Composting piggery waste: A review. Bioresource Technology. 63: 197-203.
30. Irshad, M; AE Eneji; Z Hussain & M Ashraf. 2013. Chemical characterization of fresh and composted livestock manures. J. Soil Sci. Plant Nutr. 13: 115-12.1
31. Jackson, ML. 1970. Análisis Químico de Suelos, 2ª Edición; Ed. Omega S.A. España, 652 p.
32. Kelleher, BP; JJ Leahy; AM Henihan; TF O’Dwyer & MJ Leahy. 2002. Advances in poultry litter disposal technology- a review. Bioresource Technology 83: 27-36.
33. Körner, I; M Schlegelmilch & S Rainer.1999. Regulation of nitrogen contents of composts during composting-first experimental results. pp.123-129. In: W Bidlingmaier; M de Bertoldi; LF Diaz & EK Papadimitriou (eds). Proceedings of the International Conference on Biological Treatment of Waste and the Environment (ORBIT 99) Berlin. Germany: Rhombos-Verl.
34. Kpomblekou-A, K; RO Ankumah & HA Ajwa. 2002.Trace and nontrace element contentS of broiler litter. Comunications in Soil Science and Plant Analysis 33: 1799:1811.
35. Lavergne, TK. 2002. Sampling poultry litter and soil for nutrient analysis.Louisiana State University Agricultural Center.Publicación Nº 2890.12 p.
36. Lee, JJ; RD Park; YW Kim; JH Shim; DH Chae; YS Rim; BKSohn; TH Kim & KY Kim. 2004. Effect of food waste compost on microbial population, soil enzyme activity and lettuce growth. Bioresource Technology 93: 21-28.
37. Lindsay, WL & WA Norvell.1978. Development of DTPA soil for zinc, iron, manganese and cooper. Soil Sci. Soc. Am. J. 42: 421-428.
38. Lynch, NJ & RS Cherry.1996.Winter composting using the passively aerated windrow system. Compost Sci. Util. 4: 44-52.
39. Maguire, RO & JT Sims. 2002. Soil testing to predict phosphorus leaching. J. Environ. Qual. 31: 1601-1609.
40. Martins, O & T Dewes.1992. Loss of nitrogenous compounds during composting animal wastes. Biores. Technol. 42: 103-111.
41. Ministerio de Agroindustria. Secretaria de Agricultura, Ganadería y Pesca. Presidencia de la Nación. 2015. Buenas prácticas de manejo y utilización de cama de pollo y guano. pp. 36. www.minagri.gob.ar.
42. Moore, PA; TC Daniel; DR Edwards & DM Miller. 1995. Effect of chemical amendments on ammonia volatilization from poultry litter. J. Environ. Qual. 24: 293-300.
43. Moore Jr, PA & DR Edwards. 2007. Long-term effects of poultry litter, alum-treated litter and ammonium nitrate on phosphorus availability in soils. J. Environ. Qual. 36: 163-174.
44. Murphy, J & JP Riley. 1962. A modified single solution method for the determination of phosphate in natural waters. Anal.Chim. Acta 27: 31-36.
45. Nahm KH. 2003. Evaluation of the nitrogen in poultry manure. World‘s Poult. Sci. J. 59: 77-88.
46. Ogunwande, GA; LAO Ogunjimi & JO Fafiyebi. 2008. Effects of turning frequency on composting of chicken litter in turned windrow piles. International Agrophysics 22: 159-165.
47. Parkinson, R; P Gibbs; S Burchett & T Misselbrook.2004. Effect of turning regime and seasonal weather conditions on nitrogen and phosphorus losses during aerobic composting of cattle manure. Bioresour. Technol. 91: 171-178.
48. Preusch,PL; PR Adler; LJ Sikora & TJ Tworkoski. 2002 Nitrogen and phosphorus availability in composted and uncomposted poultry litter. J. Environ. Qual. 31: 2051-2057.
49. Patterson, PH; ES Lorenz; WD Weaver & JH Schwartz. 1998. Litter production and nutrients from commercial broiler chickens. J. Appl. Poult. Res. 7: 247-252.
50. Qafoku, OS; ML Cabrera; WR Windham & NS Hill. 2001. Rapid methods to determine potentially mineralizable nitrogen in broiler litter. J. Environ. Qual. 30: 217-221.
51. Reiter, MS; TS Daniel; NA Slaton & RJ Norman. 2014. Nitrogen Availability from granulated fortified poultry litter fertilizers. Soil Sci. Soc. Am. J. 78: 861-867.
52. Riera, NI; V Della Torre; PF Rizzo; M Butti; FM Bressan; N Zarate; C Weigandt & DEC Crespo. 2014. Evaluación del proceso de compostaje de dos mezclas de residuos avícolas. Rev. FCA UNCUYO 46: 195-203.
53. Rutherford DW; AJ Bednar; JR Garbarino; R Needham; KW Stave & RL Warshaw. 2003. Environmental fate of roxarsone in poultry litter. Part II. Mobility of arsenic in soils amended with poultry litter. Environ Sci. Technol. 37: 1515-1520.
54. Rynk, R; M van De Kamp; GB Wilson; ME Singley; TL Richard; JJ Kolega; FR Gouin; L Laliberty Jr.; D Kay; DW Murphy; HAJ Hoitink & WF Brinton. 1992. On-farm composting handbook. In: R Rynk (ed). Northeast Regional Agricultural Engineering Service. Ithaca, NY. 109 p.
55. Seguel, O; V Garcia DeCortazar & M Casanova. 2003. Variación en el tiempo de las propiedades físicas de un suelo con adición de enmiendas orgánicas. AgriculturaTécnica 63: 287-297.
56. Sharpley, AN; JJ Meisinger; A Breeuwsma; JT Sims; TC Daniel & JS Schepers. 1998. Impacts of animal manure management on ground and surface water quality. pp. 173-242. In: JL Hatfield and BA Stewart (eds). Animal waste utilization:effective use of manure as a soil resource. Ann Arbor Press, Chelsea, MI.
57. Sharpley, A & B Moyer. 2000. Phosphorus forms in manure and compost and their release during simulated rainfall. J. Environ. Qual. 29: 1462-1468.
58. Sharpley, A; N Slaton; T Tabler; K VanDevender; M Daniels; F Jones & T Daniel. 2009. Nutrient analysis of poultry litter. University Arkansas. Coop. Ext. Ser. Publ. number FSA9529. 6 pages. Web site http://www uaex.edu. Fecha ultimoacceso 21-8-2016.
59. Sikora LJ & NK Enkiri. 2005. Comparison of phosphorus uptake from poultry litter compost with triple superphosphate in codorus soil. Agron. J. 97: 668-673.
60. Sistani, KR; GE Brink; SL McGowen; DE Rowe & JL Oldham. 2003. Characterization of broiler cake and broiler litter, the by-products of two management practices. Bioresource Technology 90: 27-32.
61. Sistani, KR; A Adeli; SL McGowen; H Tewolde & GE Brink. 2008. Laboratory and field evaluation of broiler litter nitrogen mineralization. Bioresource Technology 99 : 2603-2611.
62. Tam, NFY & SM Tiquia. 1993. Assessing toxicity of spent pig litter using a seed germination technique. Resour. Conserv. Recycl. 11: 261-274.
63. Tasistro, AS; DE Kissel & PB Bush. 2004 Spatial variability of broiler litter composition in a chicken house. J. Appl. Poult. Res. 13: 29-43.
64. Thompson, SA; PM Ndegwa; WC Merka & AB Webster. 2001. Reduction in manure weight and volume using an in-house layer manure composting system under field conditions. J. Appl. Poult. Res. 10: 255-261.
65. Tiquia, SM & NFY Tam. 2000. Co-composting of spent pig litter and sludge with forced aeration. Biores. Technol. 72: 1-7.
66. Tiquia, SM & NFY Tam. 2002. Characterization and composting of poultry litter in forced-aeration piles. Process Biochemistry 37: 869-880.
67. Turnell, JR; G Hinch & RD Faulkner. 2006. Preliminary assessment of the variability in broiler litter composition and its implication for vermiculture. Aust. Poult. Sci. Symp 2006. pp. 230-233.
68. Traore, O; S Sinaj; E Frossard & JM Van De Kerkhove. 1999. Effect of composting time on phosphate availability. Nutr. Cycl. Agroecosys 55: 123-131.
69. Walker, JM.1993. Control of composting odors. pp. 185-218. In: HAJ Hoitink &HM Keener (eds.). Science and engineering of composting: Design, environmental, microbiological and utilization aspects, Worthington, Ohio, USA: Renaissance Publications.
70. Walker, FR. 2010. On farm composting of poultry litter. University of Tennessee, EstadosUnidos. Plant and Soil Science Info Nº 319, 9 pages.
71. Walkley, A & TA Black. 1934. An examination of the Degtjareff methods for determining of soil organic matter, and e proposed modification of the chromic acid titration method. Soil Sci. 37: 29-38.
72. Wilkinson, SR. 1997. Response of Tifway 2 Bermuda grass to fresh or composted broiler litter containing boric acid-treated paper bedding. Commun. Soil Sci. Plant Anal. 28: 259-279.