Table 1. Treatments in evaluation.

FERTILIDAD DE SUELOS Y NUTRICIÓN VEGETAL
Evaluación del crecimiento y estado nutricional de híbridos interespecíficos de Eucalyptus sometidos a estrés por anegamiento y salinidad
Ana María Lupi1*; Pablo Santiago Pathauer2; Victoria Netto3 & Eduardo Pablo Cappa2
1 Instituto de suelos (IS), CIRN, INTA Castelar, Los Reseros y Las Cabañas (1686), Hurlingham, Buenos Aires, Argentina.
2 Instituto de Recursos Biológicos (IRB), CIRN, INTA Castelar.
3 Estudiante FAUBA.
*Autor de contacto: lupi.ana@inta.gob.ar
Recibido: 30-03-16
Recibido con revisiones: 26-09-16
Aceptado: 06-10-16
RESUMEN
Se realizó un experimento en condiciones controladas durante 90 días para estudiar la respuesta de dos combinaciones híbridas de Eucalyptus (Eucalyptus grandis x Eucalyptus camaldulensis y Eucalyptus grandis x Eucalyptus tereticornis), sometidos al efecto de 3 niveles de agua (A): 1) riego normal; 2) ciclos de 30 días de anegamiento seguido de 15 días de riego normal y 3) napa de agua permanente. A su vez, los tratamientos A2 y A3 se combinaron con 3 niveles de salinidad (CE): < 4 (control), 6 y 12 dS m-1. Quincenalmente se midió la altura y el diámetro del cuello de las plantas y se registró la mortalidad. A los 83 días se determinó materia seca en hojas, ramas y tallos, la concentración de macronutrientes foliares y se caracterizó la fertilidad del suelo de las macetas. El crecimiento de las plantas y la materia seca disminuyó significativamente con el aumento de la salinidad asociada a la inundación y la napa salina alta. La concentración foliar de Na aumentó y descendió la de K en los tratamientos con salinidad (moderada y alta). El efecto sobre el crecimiento y la biomasa fue menos adverso cuando la solución no fue salina. La solución salina agregada al suelo desplazó las bases intercambiables (Ca+Mg) y aumentó el Na y el PSI, pero la CE del suelo no superó los 4 dS m-1. El híbrido E. grandis x E. camaldulensis mostró mayores crecimientos, concentraciones foliares y biomasa en comparación con E. grandis x E. tereticornis. La menor tolerancia de este híbrido también se evidenció por la mortalidad más temprana.
Palabras clave: Estrés múltiple; Tolerancia a sal; Inundación; Eucalyptus; Condiciones controladas.
Evaluation of growth and nutritional status of interspecific hybrids of Eucalyptus subjected to waterlogging and salinity stress
ABSTRACT
An experiment was conducted under controlled conditions during 90 days to study the fortnightly response of two Eucalyptus hybrids (Eucalyptus grandis x Eucalyptus camaldulensis and Eucalyptus grandis x Eucalyptus tereticornis), subject to the effect of 3 water levels A: 1) normal watering; 2) cycles of 30 days of waterlogging followed by 15 days of normal irrigation; and 3) water table. At the same time, A2 and A3 treatments were combined with salinity levels (EC): <4 (control), 6 and 12 dS m-1. Biweekly total plant height and neck diameter were measured and mortality was recorded. After 90 days, leaf, branch and stem dry matter was determined along with foliar macronutrient concentration and soil fertility characterization in the pots. Plant growth and biomass significantly decreased with increasing salinity associated to flooding and high salty water table. Na foliar concentration increased whereas K decreased in treatments with moderate to high salinity. The effect on growth and biomass was less adverse when the solution was not saline. Saline solution added to the soil displaced exchangeable bases (Ca + Mg) and increased Na and PSI, but soil EC did not exceed 4 dS m-1. The hybrid E. grandis x E. camaldulensis showed higher growth, foliar concentration and biomass compared with E. grandis x E. tereticornis. This lower tolerance was also evidenced by earlier mortality.
Key words: Multiple stress; Salt tolerance; Waterlogging. Eucalyptus; Controlled conditions.
INTRODUCCIÓN
Argentina es el tercer país con mayor superficie de suelos
salinos y alcalinos del mundo, encontrándose distribuidos
en la planicie Chaco- Pampeana (Taboada, 2009). Las
estimaciones realizadas a partir del mapa de suelos escala
1:500.000, indican que en las provincias de Buenos Aires,
Santa Fe, Córdoba, Entre Ríos, La Pampa y San Luis existen
aproximadamente unos 11,6 millones de hectáreas afectadas por algún grado de alcalinidad (con exceso de sales
y/o sodio), muchas veces con exceso de agua (Moscatelli et al., 2000). Estas tierras marginales para la agricultura,
tienen un potencial uso para la producción forestal. Sin
embargo, el establecimiento de cultivos forestales en estos ambientes con presencia de múltiples limitantes en
forma combinada o secuencial, requiere conocer cuáles son
las especies tolerantes que pudieran sostener crecimientos económicamente rentables y sean ambientalmente
sostenibles.
De la gran cantidad de especies que pertenecen al género Eucalyptus existen algunas que se adaptan a ambientes adversos. El E. tereticornis y el E. camaldulensis, exhiben buena tolerancia a condiciones de estrés por salinidad,
bajas temperaturas, sequia e inundación prolongada (Donaldson et al., 1983; Farrell et al., 1996; NiKnam & McComb
1999; Nasim et al., 2007ab; El-Juhany et al., 2008; Johnson et al., 2009). Como la tolerancia a la salinidad u otras limitantes puede ser incompatible con otras características
deseables para los bosques cultivados (alta tasa de crecimiento, calidad de madera), suele recurrirse al desarrollo
de material híbrido que permite obtener nuevos genotipos
con las características deseables de las especies en cruzamiento.
En la Argentina y dentro del género Eucalyptus, el E.
grandis es la especie de mayor valor comercial, mayor superficie implantada (Subsecretaria de Desarrollo ForestoIndustrial del Ministerio de Agroindustria, 2016) y mayor
adaptabilidad a las condiciones ecológicas de la región
mesopotámica (Marcó, 2016). E. camaldulensis y E. tereticornis también se cultivan en la Argentina y son especies más rusticas (Pardos, 2007), poseen menor crecimiento que E. grandis pero muestran una amplia adaptabilidad a una gama importante de sitios, mayor distribución geográfica, con buena tolerancia a frío y un tipo de
madera muy apto para diversos usos (Marcó, 2016). Estas
características condujeron al inicio de un programa de cruzamientos controlados para desarrollar híbridos interespecíficos (Marcó, 2016). El potencial de uso de los nuevos híbridos podría extenderse a una gran superficie de suelos
disponibles a nivel nacional con moderadas restricciones;
aspecto que fue escasamente evaluado.
La salinidad es uno de los factores limitantes del crecimiento y la productividad de los cultivos (Gupta & Huang,
2014). Altas concentraciones de sales en el suelo alteran
la capacidad de las raíces para extraer el agua y altas concentraciones de sales dentro de la planta puede ser tóxico, resultando en una inhibición de muchos procesos fisiológicos y bioquímicos, tales como la absorción y asimilación de nutrientes (Munns & Termat, 1986; Munns,
2002, Bosco de Oliveira et al., 2013). En algunos suelos
la salinidad va acompañada por condiciones de anegamiento. Esto sucede, por ejemplo, en diferentes subregiones
de la provincia de Buenos Aires en una superficie importante de tierras con aptitud ganadero-agrícolas o ganaderas, localizadas adyacentes a vías de escurrimiento o sectores cóncavos encharcables (Sfeir, 2015). El anegamiento
también induce a múltiples disfunciones fisiológicas en las
plantas. Se inhibe la fotosíntesis y el transporte de los
carbohidratos, se reduce la absorción de macronutrientes
por la mortalidad de la raíz, la supresión del metabolismo
de la raíz, se alteran los equilibrios hormonales en las plantas, generando reducciones en la tasa de crecimiento (Kozlowsky, 1997).
El efecto combinado de estrés por salinidad y anegamiento afecta el crecimiento y la sobrevivencia de las plantas en mayor medida que cada uno de ellos en forma individual y la magnitud de afectación varían de acuerdo al
genotipo, especie, edad y el grado de la limitante (Läuchli & Epstein, 1990; Kozlowsky, 1997; Läuchli & Grattan,
2007). En este sentido, los estudios en condiciones controladas pueden resultar un mecanismo primario y efectivo para indagar sobre el comportamiento o patrón de
respuesta de los nuevos materiales genéticos sometidos
a estrés múltiple.
Dado que las características de los progenitores (E.
camaldulensis y E. tereticornis) determinan diferencias en
el comportamiento de los híbridos cuando son sometidos
a estrés múltiple, se plantea como hipótesis que los híbridos E. grandis x E. camaldulensis serán más tolerantes que E.
grandis x E. tereticornis por lo que presentarán mayores
crecimientos y mejor estado nutricional a nivel foliar. El
objetivo de este trabajo fue evaluar el crecimiento, la biomasa acumulada y los niveles nutricionales de los híbridos
interespecíficos de E. grandis x E. tereticornis y E. grandis
x E. camaldulensis sometidos a niveles de anegamiento y
salinidad, en condiciones controladas.
MATERIALES Y MÉTODOS
Los híbridos fueron producidos en tubetes de 125 cm3 a par-
tir de estacas obtenidas del banco clonal de INTA Castelar. A
los 3 meses de edad las estacas fueron trasplantadas a macetas de 3 litros, perforadas en su base, que se llenaron con el
suelo mezclado y homogenizado, obtenido a una profundidad
de 0-20 cm del predio de INTA Castelar. A partir de fracciones
de muestras de suelo tomadas de cada maceta se conformó una muestra compuesta que se secó al aire y se envió al laboratorio para su caracterización. El suelo de textura franco-limosa (Bouyoucos, 1962) presentó una concentración de carbono
orgánico (CO) de1,8% (Walkley-Black), el pH1:2,5 suelo/agua: 6,23
(Potenciométrico), la concentración de fósforo disponible (P)
fue de 43 ppm (Bray-Kurtz Nº 1). En cuanto a las bases intercambiables, las concentración de calcio (Ca) intercambiable
fue de 12,31 cmolc kg-1; el magnesio (Mg) intercambiable fue
de 1,89 cmolc kg-1; el sodio (Na) intercambiable fue de 0,45 cmolc kg-1, la capacidad de intercambio catiónico (CIC) fue de 19,8
cmolc kg-1. Tanto las bases intercambiables como la CIC se determinaron por el método de Acetato de amonio a pH 7.
Cada maceta con su correspondiente planta se dispuso
dentro de un recipiente de 4 litros sin perforación, para generar los tratamientos de inundación o napa. Similar procedimiento se siguió en el tratamiento con riego normal o testigo, para uniformar condiciones ambientales. Las plantas se
mantuvieron en esta condición por 30 días para asegurar su
establecimiento. Transcurrido este período se dio inicio al experimento que se desarrolló por 83 días (entre el 7/11/2014
y el 30/1/2015) en un invernáculo cubierto con polietileno cristal de 150 micrones de espesor.
Tratamientos y diseño experimental
El experimento se desarrolló bajo un diseño en bloques
completos al azar, con 5 repeticiones, donde se evaluaron 2
combinaciones híbridas (CH), con 3 niveles de agua (A) y 3
niveles de salinidad (CE), según se detalla a continuación en
la Tabla 1.
Tabla 1. Tratamientos en evaluación.
Table 1. Treatments in evaluation.

Cada unidad experimental se conformó de 5 individuos
(5 clones en cada combinación híbrida), los que se replicaron
5 veces. El empleo de 5 clones de cada híbrido brinda mayor
robustez al análisis planteado a nivel de CH. En total al inicio
del experimento se contó con 700 plantas.
La solución salina se preparó con sal comercial de mesa
(NaCl) y se ajustaron en laboratorio los niveles de conductividad
eléctrica deseados. Como testigo se tomó agua que se emplea
en el riego habitual del invernáculo cuya CE es de 0,8 dS m-1,
nivel que no afecta la productividad de la mayoría de las especies vegetales (SCSA, 2008).
El día de inicio del experimento se realizó la primera medición para la caracterización morfológica de los plantines, en
la cual se relevó el diámetro a nivel del cuello de las plantas
(DAC) y altura total (Ht). El DAC se midió con calibre digital
metálico de 0,01 mm de resolución, un error de indicación de ± 0,02 mm y un rango de medición de 0 a 150 mm. La altura
se midió con regla graduada al mm con un nivel de precisión
de lectura de 5 mm. Las mediciones se reiteraron cada 15 días
y se realizó una apreciación visual del estado general de las
plantas, cambios de coloración y relevamiento de mortandad
de individuos. Se calculó el crecimiento absoluto (CA) según
la siguiente ecuación.
Fórmula: CA = Cf - cI
dónde: Cf: Crecimiento al final de un período de medición, Ci:
Crecimiento al inicio de un período de medición.
A los 30 días de iniciar el experimento, los tratamientos de
inundación I, I6 e I12 fueron drenados para pasar a un período
de 15 días de riego normal. En este momento se colectó en vasos
una porción del lixiviado de cada maceta (3 tratamientos x 5
individuos x 5 repeticiones x 2 CH). En total se obtuvieron 150
muestras que fueron refrigeradas y luego se determinó CE y pH.
Al final del experimento, las plantas vivas se separaron en
los componentes hojas, ramas y tallo y se secaron en estufa
a 60-65 ºC hasta alcanzar peso constante. Se registró la materia
seca (MS) de los componentes de cada individuo y se calculó por suma la materia seca aérea. De cada unidad experimental, formada por cada tratamiento de estrés y combinación
híbrida, se preparó una muestra compuesta de hojas tomadas
en forma proporcional de cada clon. Se determinó la concentración de N (destilación), P (espectrofotometría); K, Na, Ca,
Mg (adsorción atómica). Se calculó la relación Na/K foliar comoíndice de tolerancia. La cantidad de nutrientes en hoja se calculó como producto de la concentración foliar del elemento por
la materia seca del componente hoja.
Al final del experimento se realizó un análisis del suelo de
las macetas. Para esto se formó una muestra compuesta de
cada unidad experimental, integrando de cada tratamiento
los materiales genéticos (7 tratamientos x 5 repeticiones). Se
determinó la concentración de CO, nitrógeno total (Nt)
mediante Kjeldahl, fósforo disponible, pH1:2,5 agua, conductividad
eléctrica (CE) en pasta, bases intercambiables y CIC. Se calculó el porcentaje de sodio intercambiable (PSI).
Para el análisis del efecto de los tratamientos se trabajó con
las siguientes variables: 1. pH y CE del lixiviado de los tratamientos inundados (I, I6, I12). 2. Mortalidad, 3. Crecimiento en DAC y Ht (expresado en términos nominales), 4. Variables determinadas en el suelo de las macetas, 5. Concentración y cantidad
de N, P, K, Ca, Mg, Na. 6. Materia seca en hojas, en tallos, en ramas
y materia seca aérea. En primera instancia se verificó la normalidad de los datos y se realizó un análisis de varianza (ANVA).
Se constató la no significancia de la interacción entre los efectos
principales permitiendo el análisis de los factores por separado.
Cuando el ANVA indicó diferencias significativas se compararon las medias utilizando el test de Tukey a un nivel de significancia del 5%. Se realizaron correlaciones entre variables del
suelo y entre estas y la concentración de los distintos nutrientes
determinados en hojas.
RESULTADOS
La conductividad eléctrica (CE) del lixiviado medida a los
30 días del experimento fue significativamente afectada (P < 0,05) por el nivel de salinidad del agua de riego, aumentando desde el lixiviado con agua de red en I hasta el tratamiento con agua de salinidad alta (I12). Los valores fueron
I: 1,8 (±0,77) dS m-1 < I6: 6,4 (±1,13) dS m-1 < I12:10,01 (±1,02)
dS m-1. El pH del lixiviado en I fue de 8,33; significativamente
mayor (P< 0,05) al de los lixiviados salinos (I6: 8,2 = I12: 8,16);
quienes no presentaron diferencias entre ellos. La CE del
lixiviado de las macetas que tenían el híbrido GT (5,95 ±1,16
dS m-1), fue significativamente menor (P < 0,05), al lixiviado de GC (6,55 ±1,42 dS m-1). Por su lado, el pH del lixiviado
de las macetas con GC (8,2) fue significativamente menor
(P < 0,05) al tratamiento GT (8,4).
En la Tabla 2 se muestra la evolución de la mortalidad
de individuos por fecha de observación, considerando los
días desde el inicio del experimento (DDIE). La manifestación de clorosis en hojas, necrosis en sus bordes extremos y síntomas de estrés hídrico se visualizó a partir de los 18
DDIE. A los 28 DDIE comenzaron a registrarse las primeras
muertes de individuos en la combinación híbrida GT del
tratamiento I12.
A los 42 y 53 días sumaron individuos GT
que correspondieron a I12,
I6 y N12.
A los 63 días inicia la
mortalidad de GC para los tratamientos de salinidad alta.
Al final del experimento se contaron 30 plantas muertas
de las cuales un 9% corresponde a GT y un 7,4% a GC.
Tabla 2. Evolución de la cantidad de individuos muertos según tratamiento.
Table 2. Evolution of the number of dead individuals according to the treatments.
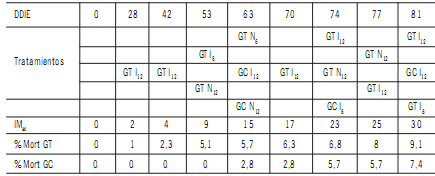
Ref.: DDIE: días desde el inicio del experimento. IMac: individuos muertos expresado en forma acumulada.
En la Tabla 3 se muestra el crecimiento absoluto (CA) en Ht (cm), para los diferentes tratamientos de estrés y para los híbridos evaluados, hasta los 83 días. La Ht comenzó a ser afectada en forma significativa a partir de los 15 DDIE en I12, N12, e I6. Los menores valores se presentaron en todo momento en I12 y en I6 sin diferencias significativas (P > 0,05) entre ellos. El tratamiento I tampoco se diferenció de I6 pero sí lo hizo de I12. Al comparar solamente los tratamientos con agua de riego no salina se observa que el CA de las plantas en N fue significativamente mayor (P < 0,05) a I. N y N6 fueron similares hasta los 60 días a partir del cual comienza a decrecer el CA de las plantas sometidas a la napa salina intermedia. Los mayores CA en altura se presentaron en los tratamientos testigo y napa (N), las que fueron similares entre si a lo largo del ciclo. En cuanto a los materiales genéticos, el híbrido GC tuvo un mayor CA en altura en relación a GT en todo el ciclo en estudio.
Tabla 3. Crecimiento absoluto en altura (cm) para los diferentes tratamientos de estrés y para los materiales
genéticos.
Table 3. Absolute growth in height (cm) for the different stress treatments and genetic materials.

Ref: Para cada columna, letras diferentes indican diferencias significativas a p< 0,05. LI: periodo libre de inundación en
los tratamientos I, I6 e I12. T: Riego normal con agua de vivero. N: Maceta con agua de vivero 1/3 de su altura. N6: Maceta
con agua salina de CE de 6 dS m-1, hasta 1/3 de su altura; N12: Maceta con agua salina de CE de 12 dS m-1, hasta 1/3 de
su altura. I: 30 días anegamiento con agua de red, drenado y 15 días riego normal con agua de vivero. I
El DAC también fue por los tratamientos de estrés. Los tratamientos comienzan a afectar el crecimiento a partir de los 30 días y se acentúan con el transcurso del tiempo. Los menores crecimientos (P < 0,05) se presentaron en N12 e I12 y los mayores en T, Napa (N) e inundación (I) (Fig. 1). En concordancia con lo observado para la Ht, los CA siempre fueron superiores en GC en comparación con GT (Fig. 2).

Figura 1. Efecto de los diferentes tratamientos
de estrés multiple sobre el crecimiento
en díametro a la altura del cuello.
Figure 1. Effect of diferent treatments of
multiple stress on the diameter growth
in root collar height.

Figura 2. Efecto de los diferentes materiales
genéticos sometidos a estrés múltiple
sobre el crecimiento en diámetro a la
altura del cuello.
Figure 2. Effect of different treatments of
stress on the diameter growth in
root colar height.
Al finalizar el experimento, la materia seca total aérea y la materia seca de cada componente fue significativamente (P < 0,05) afectada por los tratamientos de salinidad y anegamiento (Tabla 4). Las plantas del tratamiento I12, I6 y N12 presentaron las menores cantidades de MS total aérea. La MS en tallos fue afectada significativamente (P < 0,05) por I12 y en menor medida por I6, N12 y N6. La MS en ramas también fue afectada (P < 0,05) por I12, siendo la MS en I6, N12, N6 e I una situación intermedia. Particularmente en el componente hojas, I12 acumuló menos MS, luego N12 e I6. En el caso de los tratamientos con napa salina, el N12, no se diferenció significativamente del I6 independientemente del componente considerado. El tratamiento con napa de salinidad intermedia fue similar (P > 0,05) a la napa e inundación con agua no salina.
Tabla 4. Materia seca aérea total, en ramas, tallos y hojas (g pl-1) para dos combinaciones híbridas
sometidas a diferentes tratamientos de estrés múltiple.
Table 4. Total aerial dry matter, in branches, stems and leaves (gr pl-1) for two hybrid combinations
subjected to different multiple stress treatments.
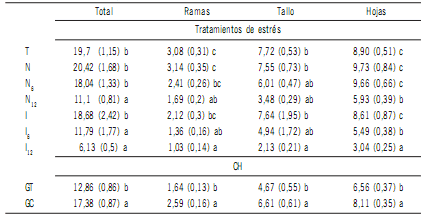
Ref.: El valor entre paréntesis es el error estándar de la muestra. Para cada componente, letras diferentes indican diferencias significativas a un nivel significancia del 0,05. T: Riego normal con agua del vivero. N: Maceta con agua del vivero
hasta 1/3 de su altura. N6: Maceta con agua salina de CE de 6 dS m-1, hasta 1/3 de su altura; N12: Maceta con agua
salina de CE de 12 dS m-1, hasta 1/3 de su altura. I: 30 días anegamiento con agua del vivero, drenado y 15 días riego
normal con agua del vivero. I6: 30 días anegamiento con agua salina de 6 dS m-1, drenado y 15 días riego normal con
agua del vivero. I12: 30 días anegamiento con agua salina de 12 dS m-1, drenado y 15 días riego normal con agua del
vivero. GC: E. grandis x E. camaldulensis.GT: E. grandis x E. tereticornis.
Los tratamientos T, N e I no mostraron diferencias
significativas en la cantidad de MS acumulada en todos los
componente (Tabla 4) y presentaron valores superiores
(P < 0,05) a los tratamientos salinos N12, I6 e I12. Esta diferencia se observa con mayor claridad en el componente
hojas y en biomasa total aérea. En relación a los materiales
genéticos el híbrido GC acumuló más biomasa que GT
(Tabla 4).
Al final del experimento, el suelo de las macetas present ó similares condiciones en relación a la CIC y a las
concentraciones de CO, N total, P disponible, Mg y de K
intercambiable. Las mayores concentraciones de Na y los
más altos PSI se encontraron en los tratamientos de salinidad moderada y alta, sin diferencias entre ellos, independientemente sea napa o inundación. Los tratamientos
con mayor crecimiento y biomasa (T, N e I), presentaron la mayor concentración de Ca+Mg, el valor más alto de la
suma de bases (Ca+Mg+K+Na) y el porcentaje de saturación de bases (Tabla 5).
Tabla 5. Nivel de fertilidad del suelo en diferentes tratamientos de estrés múltiple al final del experimento.
Table 5. Soil fertility level in different treatments of multiple stress at the end of the experiment.

Ref.: pH en agua; CE: conductividad eléctrica (dS m-1); PSB: Porcentaje de saturación de bases; SB: suma de bases; PSI: Porcentaje de sodio intercambiable. El valor
entre paréntesis es el error estándar de la muestra. Para cada variable, letras diferentes indican diferencias significativas a un nivel significancia del 0,05. T: Riego
normal con agua del vivero. N: Maceta con agua del vivero hasta 1/3 de su altura. N6: Maceta con agua salina de CE de 6 dS m-1, hasta 1/3 de su altura; N12: Maceta
con agua salina de CE de 12 dS m-1, hasta 1/3 de su altura. I: 30 días anegamiento con agua del vivero, drenado y 15 días riego normal con agua del vivero. I6: 30
días anegamiento con agua salina de 6 dS m-1, drenado y 15 días riego normal con agua del vivero. I12: 30 días anegamiento con agua salina de 12 dS m-1, drenado
y 15 días riego normal con agua del vivero. GC: E. grandis x E. camaldulensis. GT: E. grandis x E. tereticornis.
Las concentraciones de nutrientes foliares no fueron
significativamente afectadas (P > 0,05) por los tratamientos y solo se halló diferencias (P < 0,05) en la concentración de Mg según los materiales genéticos, siendo mayor
en GC.
En la Tabla 6 se brindan las cantidades de nutrientes
foliares de cada tratamiento y cada combinación híbrida, al final del experimento. Las cantidades de nutrientes fueron afectadas significativamente (P < 0,05) por los tratamientos. Independientemente del nutriente considerado,
el I12 acumuló la menor cantidad. Dentro de los tratamientos napa también se aprecia una disminución (P<0,05) en
la cantidad de Ca, Mg y K con la salinidad alta. La napa de
salinidad intermedia se comportó como la napa no salina.
Las cantidades de nutrientes fueron similares en T, N e I.
La cantidad de Ca, Mg y P fue mayor en N6 respecto de I6.
El K descendió significativamente (P < 0,05) con el aumento de la salinidad en los tratamientos inundados. En cuanto a las CH, solo se hallaron diferencias (P < 0,05) en la
cantidad de Mg, K, Na y P siendo mayor e GC.
Tabla 6. Cantidad de nutrientes foliares por tratamiento y por híbrido intra-especifico al final del experimento.
Table 6. Foliar nutrients by treatment and intra-specific hybrid at the end of the experiment.
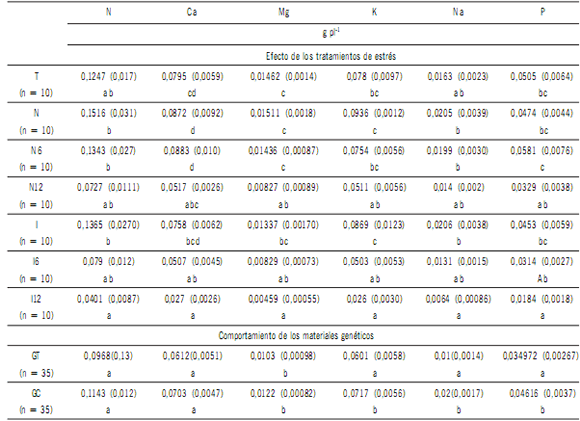
Ref.: Para cada elemento, letras diferentes indican diferencias significativas a un nivel significancia del 0,05. T: Riego normal con agua del vivero. N: Maceta con agua
del vivero hasta 1/3 de su altura. N6: Maceta con agua salina de CE de 6 dS m-1, hasta 1/3 de su altura; N12: Maceta con agua salina de CE de 12 dS m-1, hasta 1/3 de su altura. I: 30 días anegamiento con agua del vivero, drenado y 15 días riego normal con agua del vivero. I6: 30 días anegamiento con agua salina de 6 dS m-1, drenado y 15 días riego normal con agua del vivero. I12: 30 días anegamiento con agua salina de 12 dS m-1, drenado y 15 días riego normal con agua del vivero. GC: E. grandis x E. camaldulensis. GT: E. grandis x E. tereticornis.
La relación Na/K no fue modificada por los tratamientos (P > 0,05) y varió desde 0,18 en N hasta 0,32 en N6. Tampoco se hallaron diferencias entre los híbridos (P > 0,05), alcanzando un valor de 0,25 para GC y 0,26 para GT.
DISCUSIÓN
El pH del lixiviado cambió significativamente con los
tratamientos; sin embargo entendemos que en términos
nominales no serían determinantes desde el punto de vista
biológico. A diferencia del I6, la CE del lixiviado del I12 fue
algo inferior a la CE de la solución de riego, posiblemente
debido a que iones de Na ocuparon sitios de intercambio
en el suelo. Del mismo modo se considera poco relevante
las diferencias estadísticas halladas a nivel de CH en cuanto el pH.
La sobrevivencia es un indicador importante para la
selección de materiales tolerantes a suelos salinos (Marcar et al., 2003). Los tratamientos T, N e I no registraron mortalidad de individuos en ninguna de las CH, sugiriendo que
frente a condiciones de inundación no salina ambas especies son tolerantes a períodos superiores a los evaluados
en este experimento. La mortalidad aumentó en el orden
N12< I6 <I12. La sobrevivencia fue del 91% para GT y 92,5%
GC. Estos valores en principio no marcarían diferencias
importantes, sin embargo, los materiales GT inician la
mortalidad a los 30 días de iniciar el experimento, mientras que en GC los hacen a los 60 días. Los individuos GC
presentarían mecanismos más eficientes para sostener
su sobrevivencia por un mayor período ya que en condiciones de alta salinidad e inundación pudieron continuar
creciendo. Este comportamiento de verificarse en condiciones de campo representaría un signo importante de tolerancia a condiciones de estrés múltiple en períodos de
estrés relativamente cortos. La mayor tolerancia a la salinidad en condiciones de campo de E. camaldulensis donde la salinidad en suelos de 8-31 dS m-1 también fue re portada por Dan & Dickinson (1995) y Akhtar et al. (2008).
El efecto de la salinidad se manifestó en forma progresiva. Las variables morfológicas relevadas DAC y Ht y la
materia seca fueron sensibles a diferentes tratamientos de
estrés (Qureshi et al., 2000; Arshi et al., 2002; Isla et al.;
2004). El crecimiento en altura fue afectado en mayor medida por el anegamiento mientras que el DAC fue más
afectado por la salinidad.
Los crecimientos absolutos y la materia seca de los
híbridos fueron afectados en mayor medida por la combinación alta salinidad e inundación en relación al efectoúnico de la inundación (Isla et al., 2004). El efecto depresor
de la napa fue menor a la inundación. La combinación de
la napa con salinidad alta afecta negativamente en comparación a la napa no salina o de salinidad media. El efecto
negativo de N12 fue similar a I12 en los componentes de la
MS aérea, tallos y ramas. Por el contrario, la MS en hojas
fue menos afectada que en I12.
El anegamiento como único factor de estrés afecta
adversamente el crecimiento de tallos y la longitud de
entrenudos, suprime la formación y la expansión de hojas
y genera una prematura senescencia foliar (Kozlowsky,
1997). Los tratamientos N e I presentaron un patrón similar con el aumento de la salinidad aunque la magnitud
de la afectación fue menor en N. El tratamiento I afectó el crecimiento a partir de los 15 DDIE y a partir de los 45
días se suma el efecto de la salinidad cuando en I12 disminuye su CA en relación a I. Las plantas de menores dimensiones, en todo momento se encontraron en I12 y en I6 sin
diferencias significativas entre ellos. Los CA de N y T fueron similares en todo el ciclo del estudio y superiores a los
demás tratamientos.
En el tratamiento N, la presencia de
un reducido volumen de suelo libre de agua permitió sostener crecimientos similares a T. Los tratamientos N, N6
y
N12, no fueron significativamente diferentes durante los
primeros 30 DDIE, pero la salinidad alta afectó el CA en Ht
a partir de los 45 DDIE y la salinidad media a partir de los
75 DDIE. Al final del estudio los CA en Ht de N12 y N6 fue
1,5 veces y 1,2 menor a N, respectivamente. La napa de
salinidad intermedia afecto el CA de Ht en comparación a
la napa no salina. Los tratamientos con menor crecimiento
en DAC fueron I12 y N12. Esta diferencia comenzó a observarse desde los 30 DDIE. Los tratamientos N6 e I6 arrojaron
valores intermedios y no se diferenciaron entre ellos. Los
tratamientos T, N e I, con los mayores crecimientos, se
diferenciaron del resto. En cuanto a los materiales genéticos,
el híbrido GC tuvo un mayor CA en Ht y en DAC, en relación a GT en todo el ciclo en estudio.
La similitud en la MS acumulada en los tratamientos
T, N, I e N6, refleja la tolerancia de los híbridos a niveles de
CE de 6 dS m-1. I12 fue el tratamiento con mayor afectación
sobre todos los componentes de la MS.
Debido al consumo de agua de las plantas, el agua de
las macetas de los tratamientos salinos debió reponerse
muy frecuentemente durante los primeros 45 días del experimento; similar a los tratamientos no salinos. Sin embargo, la reposición disminuyó con el tiempo e inclusive,
en los últimos 15-20 días no fue necesario hacerlo. La reducción en el consumo de agua indica la disminución de
la transpiración, cambios en la apertura estomática y reducción de la actividad fotosintética (van der Moezel et al.,
1989; Rodríguez de Souza et al., 2015), que se traduce en
pérdidas de crecimiento y menor acumulación de biomasa
aérea. Cuando se compara T versus I12 se observa que la
MS en hojas y ramas fue menos afectada que la MS en tallo
(2,9; 2,99 y 3,6 veces mayor a T, respectivamente). La afectación a nivel de MS de tallo principal podría alterar la conductividad hidráulica comprometiendo el transporte de
agua y la actividad a nivel de hojas. Ante esta situación se
plantea, por un lado, la reducción del número y biomasa
de hojas como una estrategia para soportar el estrés hídrico
generado por la alta salinidad, ya que reducirá el área de
la transpiración logrando una mayor supervivencia o aumentando el período de permanecer con vida. Por otro lado,
el desarrollo de hojas dependen del suministro de agua y ante esta restricción, debido a la presencia de agua salina,
son afectados los metabolismos (disminuye la disponibilidad de hidratos de carbono u hormonas de crecimiento
para las regiones meristemáticas) que intervienen en la
formación y desarrollo de nuevas hojas y con ello el crecimiento (Kozlowsky, 1997; Ashraf & Sarwar, 2002; de
Souza et al., 2015).
La mayor tolerancia de GC permitió sostener el área
foliar fotosintética por un mayor período y tener mayores
crecimientos (Lauchli & Grattan, 2007). La mayor plasticidad de GC puede ser atribuida a que la especie pura E.
camaldulensis tolera condiciones de media a alta concentración de sal y anegamiento como los indicaron Niknam& McComb (1999) y Johnson et al. (2009). En algunas
especies como Casuarina, se atribuyó la mayor tolerancia
a la inundación a un incremento en el porcentaje de aerénquimas en la raíz (Van Der Moezel et al., 1989; Kozlowsky, 1997; Isla et al., 2014). Nuestra observación no sería
coincidente con Reis Mendonça (2007), quienes indican
que E. tereticornis tolera mayores niveles de salinidad
que E. camaldulensis.
Las mejores condiciones de fertilidad de suelo en T, N
e I lograron generar los mayores CA y la mayor acumulación de materia seca. En los tratamientos de menor crecimiento, mayor mortalidad y menor acumulación de MS
(I12,
I6 y N12), el suelo presentó la mayor concentración de
Na, mayor PSI y mayor CE. Las relaciones analizadas indican que el aumento de la CE del suelo se explicó a partir
del aumento en la concentración salina de la solución aplicada (r = 0,86; P < 0,05). La menor CE del lixiviado, en comparación a la solución salina, de las macetas del tratamiento I12 expresa que parte del Na de la solución de riego ocupó sitios de intercambio del suelo aumentando el PSI (r = 0,98;
P< 0,05) y desplazando los iones Ca y Mg (r = -0,61; P < 0,05). Este desplazamiento de bases puede ser el responsable de la caída del pH y la CE del lixiviado. Parte del Na
pudo pasar a la planta y la restante permaneció en la solución cuando se interrumpió la absorción de agua y se
descartó al final de ensayo. Si bien al final del experimento el suelo de los tratamientos salinos muestran mayores
niveles de salinidad en comparación con T, N e I; en ninguno de los casos superó los 4 dS m-1 y el pH no alcanzó el valor de 8, valor determinado en el lixiviado.
Al comparar las concentraciones foliares no pudimos
verificar cambios en los niveles de Na en los tratamientos
salinos. Es posible que se deba a un efecto confundido ya
que se trabajó a nivel de combinación híbrida (mezcla de 5 clones). Esto podría estar enmascarando las diferencias
en las concentraciones foliares de nutrientes que presentaron una alta variabilidad. Sin embargo, hallamos cierta
asociación significativa (r = 0,63; P < 0,05), entre la concentración de Na en el suelo y la concentración foliar de
este elemento (Isla et al., 2014). Además, la concentración
foliar de K se correlacionó parcialmente y en forma negativa con la concentración foliar de Na (r = - 0,58; P < 0,05).
De esto se desprende que la salinidad alta limitó la absorción de nutrientes como el K, por la inhibición generada
por el Na. El K es un elemento esencial para el crecimiento
y desarrollo y niveles no adecuados resultan en una menor
productividad y puede incluso conducir a la muerte (James et al., 2011). Su menor absorción habría afectado procesos metabólicos involucrados en el mantenimiento de los
niveles hídricos óptimos a nivel celular, en la acumulación,
translocación de carbohidratos y la regulación de la apertura estomática (Nabil & Coudrest, 1995; Talbott & Zeiger,
1996). La relación Na/K foliar suele ser tomada como uníndice de tolerancia a la salinidad, siendo mayor la tolerancia cuando disminuye la relación. En este trabajo, esta
variable no cambió a nivel de materiales genéticos.
El estudio en condiciones controladas resultó apropiado para analizar patrones primarios de respuesta ya que
permiten trabajar en un área pequeña, tener una alta repetitividad de tratamientos, controlando los factores en
evaluación. Sin embargo, la tolerancia a la salinidad de
algunas especies de Eucalyptus obtenida a partir de los
resultados de experimentos en CC no siempre se corresponde linealmente con las repuestas obtenidas en condiciones de campo (Lauchlin & Grattan, 2007).
CONCLUSIONES
Bajo las condiciones en que se realizó el experimento
se puede concluir que:
Los híbridos interespecíficos fueron afectados negativamente en sus parámetros morfológicos y nutricionales
al ser sometidos a estrés múltiple (anegamiento x salinidad). La tolerancia de los híbridos testeados fue mayor cuando se sometieron solamente al estrés por anegamiento.
El híbrido E. grandis x E. camaldulensis es más tolerante a condiciones de estrés múltiple; mostró mayor crecimiento, acumuló mayor biomasa y resistió por mayor tiempo a la mortalidad en comparación al E. grandis x E. tereticornis.
La combinación híbrida de E. grandis x E. camaldulensis
toleró niveles de salinidad de 6 dS m-1 y ambas combinaciones híbridas fueron fuertemente afectados a niveles de
salinidad de 12 dS m-1. Los tratamientos no salinos no
afectaron la biomasa total acumulada, presentando una
performance similar al tratamiento con riego normal.
AGRADECIMIENTOS
Al proyecto Componente 2 Plantaciones Forestales Sustentables del Proyecto Manejo sustentable de los Recursos Naturales BIRF 7020 AR y al Programa de Mejoramiento Genético por medio del cual se generaron lo híbridos y el financiamiento de las actividades del experimento. Al personal de apoyo del IRB Bosques cultivados.
BIBLIOGRAFÍA
1. Akhtar, J; ZA Saqib; RH Qureshi; MA Haq; MS Iqbal & NE Marcar. 2008. The effect of spacing on the growth of Eucalyptus camaldulensis on salt-affected soils of the Punjab, Pakistan. Canadian Journal of Forest Research 38: 2434-2444.
2. Arshi, A; MZ Abdin & M Iqbal. 2002. Growth and metabolism of Senna as affected by salt stress. Biologia Plantarum 45: 295-298.
3. Bosco de Oliveira, A; NL Mendes Alencar & E Gomes-Filho. 2013. Comparison between the water and salt stress effects on plant growth and development, Eresponses of organisms to water stress, Sener Akinci (ed), In: Tech http://www.intechopen.com/books/responses-of-organisms-to-water-stress/comparison-between-the-water-and-salt-stress-effects-on-plant-growth-and-development. Consultado en 27/9/2016.
4. Dan, S & GR Dickinson. 1995. Salinity effects on tree growth, root distribution and transpiration of Casuarina cunninghamiana and Eucalyptus camaldulensis planted on a saline site in tropical north Australia. Forest Ecology and Management 77(1-3): 127-138.
5. Donaldson, DR; JK Hasey & WB Davis. 1983. Eucalyptus out-perform other species in salty, flooded soils. Calif. Agr. 37(9&10): 20-21.
6. El-Juhany, LI; IM Aref & AIM Ahmed. 2008. Response of Eucalyptus camaldulensis, Eucalyptus microtheca and Eucalyptus intertexta seedlings to Irrigation with Saline Water. World Journal of Agricultural Sciences 4(S): 825-834.
7. Farrell, RCC; DT Bell; K Akilan & J KMarshall. 1996. Morphological and physiological comparisons of clonal lines of Eucalyptus camaldulensis. Responses to waterlogging/salinity and alkalinity. Austral. J. Plant Physiol. 23: 509-518.
8. Gupta, B & B Huang. 2014. Mechanism of Salinity Tolerance in Plants: Physiological, Biochemical, and Molecular Characterization. Review Article. International Journal of Genomics 2014: 1-19.
9. Isla, R; M Guillen & R Aragues. 2014. Response of five tree species to salinity and waterlogging: shoot and root biomass and relationships with leaf and root ion concentrations. Agroforest Syst. 88: 461-477.
10. James, RA; C Blake; CS Byrt & R Munns. 2011. Major genes for Na+ exclusion, Nax1 and Nax2 (wheatHKT1;4 and HKT1;5), decrease Na+ accumulation in bread wheat leaves under saline and waterlogged conditions. Journal of Experimental Botany 62(8): 2939-2947.
11. Johnson, I; R Coburn & C Barton. 2009. Tree planting to control salinity. PRIMEFACT 983. 8p. www.dpi.nsw.gov.au/primefacts. Consultado el 1/9/2016.
12. Kozlowski, TT. 1997. Responses of woody plants to flooding and salinity. Tree Physiology Monograph No 1. 29 p.
13. Läuchli, A & SR Grattan. 2007. Plant growth and development under salinity stress. MA Jenks; PM Hasegawa & SM Jain (eds). Advances in Molecular Breeding Toward Drought and Salt Tolerant Crops. Capitulo 1. 1-32. Springer Netherlands.
14. Marcar, NE; DF Crawford; AKMA Hossain & AT Nicholson. 2003. Survival and Growth of tree species and provenances in response to salinity on a discharge site. Australian Journal of Experimental Agriculture 43: 1293-1302.
15. López, JA; M Marcó; L Harrand; P Pathauer; MN García; AJ López; J Oberschelp; C Vera Bravo; E Cappa; C Acuña & P Villalba . 2016. Subprograma Eucalyptus y otras latifoliadas (Corimbia y Grevilea). En: M Marcó & CI Llavallol (eds). Domesticación y mejoramiento de especies forestales. 1era Edición. Pp 47-84. Ministerio de Agroindustria. Unidad para el Cambio Rural- UCAR. CABA, Argentina. 422 p.
16. Moscatelli, G; G Cruzate & L Lutters. 2001. Suelos alcalinos en el centro-este de la República Argentina Instituto de Suelos CRN INTA. 3er International conference on land degradation and meeting of the IUSS subcommission c - soil and water conservation. Editor EMBRAPA.
17. Munns, R. 2002. Comparative physiology of salt and water stress. Plant Cell Environ. 25(2): 239-250.
18. Munns, R & A Termaat.1986. Whole-plant responses to salinity. Australian Journal of Plant Physiology 13: 143-160.
19. Nabil, M & A Coudrest. 1995. Effects of sodium chloride on growth, tissue elasticity and solute adjustment in two Acacia nilotica subspecies. Physiol. Plant. 93: 217-224.
20. Nasim, M; RH Qureshi; M Saqib; T Aziz; S Nawaz; J Akhtar; & M Anwarul-Haq. 2007a. Properties of salt affected soil under Eucalyptus camaldulensis plantation in field conditions. Pak. J. Agri. Sci. 44(3): 401-414.
21. Nasim, M; RH Qureshi; T Aziz; M Saqib; S Nawaz; ShT & Sh Pervaiz. 2007b. Screening trees for salinity tolerance: a case-study with ten eucalyptus species. Pak. J. Agri. Sci. 44(3): 385-396.
22. Niknam, SR & J McComb. 2000. Salt tolerance screening of selected Australian woody species - a review. Forest Ecol. and Management 139(1-2):1-19.
23. Pardos, JA. 2007. Perspectiva fisiológica en la producción y mejora del Eucalipto (con énfasis en Eucalyptus globulus Labill). Boletín del CIDEUS 3: 7-55.
24. Qureshi, TM; M Aslam; F Hussain & AY Ashraf. 2000. Performance of Eucalyptus camaldulensis under different types of Salt-Affected Soils. International Journal Of Agriculture & Biology 2(1-2): 45-47.
25. Ramoliya, PJ & AN Pandey. 2002. Effect of increasing salt concentration on emergence, growth and survival of seedlings of Salvadora oleoides (Salvadoraceae). J. Arid Environ. 51: 121-132.
26. Reis Mendonça, AVR; JG Carneiro; DG Barroso; RS Anderson; LA Rodrigues & TA Soares de Freitas. 2007. Características biométricas de mudas de Eucalyptus sp. sob estresse salino. Árvore 31(3): 365-372.
27. Rodrigues de Souza, B; IAS Freitas; L Vinicius de Araujo; R Vanessa do Rosario & FS Matos. 2015. Growth of eucalyptus plants irrigated with saline water. African Journal of Agricultural Research 10(10): 1091-1096.
28. Salter, J; K Morris; PCE Bailey & PI Boon. 2007. Interactive effects of salinity and water depth on the growth of Melaleuca ericifolia Sm. (Swamp paperbark) seedlings. Aquatic Bot. 86: 213-222.
29. Sfeir, AJ. 2015. Provincia de Buenos Aires. En: Casas R & G Albarracin (eds): El deterioro del suelo y del ambiente en Argentina. Erosión y degradación de Suelos. Tomo II, Parte 7. Pp 31. Fundación Ciencia, Educación y Cultura. FECIC 2. CABA, Argentina. 456 p.
30. Soil Science Society of America. 2008. Glossary of Soil Science Terms. Soil Science Society of America, Madison, Wisconsin. USA. http://blogs.upm.es/techenglish/wp-content/uploads/sites/53/2015/05/Soil-Science-glossary.pdf. Consultado el 27/8/2016.
31. Subsecretaria de desarrollo foresto-industrial del Ministerio de Agroindustria. 2016. http://forestoindustria.magyp.gob.ar/plantaciones-forestales. Consultado el 27/8/2016.
32. Taboada, M. 2009. Alteraciones de la fertilidad causadas por el hidromorfismo. En: Taboada M &R Lavado (eds). Alteraciones de la fertilidad de los suelos. El halomorfismo, la acidez, el hidromorfismo y las inundaciones. Cap 4.1-43. EFA, Buenos Aires, Argentina. 160 pp.
33. Talbott, LD & E Zeiger. 1996. Central role for potassium and sucrose in guard cell osmoregulation. Plant Physiolgy 111: 1051-1057.
34. Van Der Moezel, PG; LE Watson & DT Bell. 1989. Gas exchange responses of two Eucalyptus species to salinity and waterlogging. Tree Physiology 5: 251-257.