BIOLOGÍA DEL SUELO
Ensamble de nematodos en una cronosecuencia en suelo salino y fertilizado,
en un huerto frutícola
María C Aruani1*; Claudia V Azpilicueta2; Pablo Reeb1 & María A Arias2
1 Universidad Nacional del Comahue (UNCo), Facultad de Ciencias Agrarias, Río Negro, Argentina.
2 LASAF. Laboratorio de Servicios Agrarios y Forestales. Subsecretaría de Producción, Neuquén, Argentina.
* Autor de contacto: mcaruani@gmail.com
Recibido: 10-08-16
Recibido con revisiones: 17-02-17
Aceptado: 17-02-17
RESUMEN
El ensamble de nematodos del suelo fue estudiado en una cronosecuencia (S1, S2 y S3) que incluyó a los ciclos productivos
2008-2009, 2009-2010 y 2010-2011 con distinto plan de fertilización nitrogenada: 776, 375 y 80 kg N ha-1, respectivamente, en un suelo salino (5,2 dS m-1) franco limoso, en un huerto comercial de pera. La aplicación de nitrógeno en S1 y
S2 fue repartida en siete veces y en S3 tres veces. Se evaluaron características del suelo, abundancia de nematodos, índices
ecológicos y el rendimiento de fruta. El contenido de materia orgánica (4,2%) y de nitrato (29,5 mg kg-1) en el suelo y el
pH del suelo (7,64) no variaron en la cronosecuencia. Las arcillas esmectitas, minerales dominantes en el suelo, presentan
gran capacidad buffer y tienen alta resistencia al cambio del pH cuando se agrega fertilizante nitrogenado al suelo. Los nematodos fitófagos fueron el grupo trófico más abundante (48%) y las familias pertenecientes a los herbívoros del grupo c-p=2 fueron dominantes. Aporcelaimellus representó el 16% de la abundancia total de nematodos. En S1, el aumento en
el índice de enriquecimiento (78,6%) fue atribuido a una alta abundancia de bacteriófagos del grupo c-p=1 (Ba1) y fungívoros
del grupo c-p=2 (Fu2), donde la dosis de nitrógeno aplicada fue mayor, respecto a S2 y S3. El número de Panagrolaimidae
y Rhabditidae aumentó en S1. El contenido de nitrato en el suelo no se correlacionó con la abundancia de Ba1 y Fu2. Ni la
densidad de nematodos omnívoros y carnívoros ni los índices de estructura (81,4%), canal (14,2%) y basal (11,1%) fueron
alterados por la aplicación de nitrógeno en los ciclos productivos. El valor bajo del índice canal indicó una ruta de descomposición
bacteriana de la materia orgánica del suelo. El rendimiento total de frutos fue similar en la cronosecuencia.
Palabras clave: Conductividad eléctrica; Grupos funcionales de nematodos; Perales; Fertilización nitrogenada, Alto Valle de
Río Negro.
Nematode assemblage in a chronosequence on saline soil and fertilizated,
in a fruit orchard.
ABSTRACT
Soil nematode assemblage was studied in a chronosequense (S1, S2 y S3) that included 2008-2009, 2009-2010 and 2010-2011 growing seasons of a pear commercial orchard with different nitrogen fertilizer management: 776, 375 and 80 kg
N ha-1, respectively, in a silt loam saline soil (5.2 dS m-1). Nitrogen application in S1 and S2 was split in seven times and
in S3 in three times. Soil characteristics, nematode abundance, ecological indices, and fruit yield were evaluated. Organic
matter (4.2%), nitrate (29.5 mg kg-1) content and soil pH (7.64) did not change in the chronosequence. Smectite clays,
that are one of dominant minerals in the soil, exhibit high buffering capacity and high resistance to change in pH when
the nitrogen fertilizer is applied to the soil. Plant-feeding nematodes were the most abundant trophic group (48%) and the
families belonging to the herbivores of c-p 2 guild were dominant. Aporcelaimellus represented a 16% of total abundance
of nematodes. In S1, the increase in enrichment index (78.6%) was attributed to the high abundance of bacterivores of
c-p=1 guild (Ba1) and fungivores of c-p=2 guild (Fu2), where the rate of nitrogen applied was greater, respect to S2 and S3.
The numbers of Panagrolaimidae and Rhabditidae increased in S1. Soil nitrate content was not correlated with Ba1 and Fu2
abundance. Neither omnivores and carnivores density nor indices of structure (81.4%), channel (14.2%) and basal (11.1%)
were altered by nitrogen application in the growing seasons. The low value of channel index indicated a bacterial
decomposition pathway of soil organic matter. The pear fruit yield was similar in the chronosequense.
Key words: Electric conductivity; Nematodes functional group; Pear tree; Nitrogen fertilization; Upper Valley of Rio Negro.
INTRODUCCIÓN
La salinidad junto con la compactación y contaminación que presentan los suelos de regadío, son factores de
degradación del mismo que afectan la sustentabilidad de
los agroecosistemas. La utilización del riego ha incrementado la producción agrícola a nivel mundial, sin embargo
esta práctica de manejo pobremente adaptada a las condiciones locales propicia la degradación del suelo (FAO,
2011). Se estima que el 11% de las áreas irrigadas están
afectadas por algún nivel de salinización. China, EE. UU.,
Pakistan, India y México representan más del 60% del total
de estas áreas. En la Argentina, en la zona del Alto Valle
del río Negro, la presencia de niveles freáticos poco profundos asociados a procesos progresivos de salinización
de los suelos abarca cerca de 40% de la superficie regada
(Galeazzi & Álvarez, 1998). Skogerboe (1986) señala que
la fuente de sal proviene de la formación geológica de apoyo
de las gravas y areniscas aluvionales, esta formación se
encuentra altamente fracturada y tiene pequeños canales
de algunos metros de profundidad que contribuyen al ascenso de las sales. El proceso de salinización en el suelo se
ve potenciado por el sistema de riego a manto que es de
baja eficiencia (Aruani et al., 2007) y trae aparejado el ascenso de los niveles de la freática y el proceso progresivo
de salinización de los suelos.
El rendimiento de los cultivos puede ser afectado negativamente por un desorden nutricional inducido por la salinidad, debido a que las sales afectan la disponibilidad y el
transporte o partición de los nutrientes en la planta (Grattan & Grieve, 1999; Hu & Schmidhalter, 2005). Además, el estrés salino induce la deficiencia de iones o su desequilibrio
debido a la competencia de nutrientes tales como K+, Ca+2
y NO3- con los iones tóxicos Na+ y Cl-. Algunos estudios demostraron que el efecto negativo de las sales sobre la producción de los cultivos puede ser aminorado con un buen
estado nutricional (Grattan & Grieve, 1999; Chen et al., 2010), aunque la competencia entre los iones Cl- y NO3- en condiciones salinas, compromete la absorción de nitrógeno que juega un papel crítico en la determinación del
crecimiento de las plantas en suelos salinos.
Los nematodos del suelo se encuentran en todos los
hábitat que les provea de una fuente de carbono y son esenciales en facilitar la mineralización de la materia orgánica
y supresión de plagas, entre otras funciones (Ferris & Bongers, 2006). Estos organismos presentan una cutícula
permeable que les permite reaccionar rápidamente a los
disturbios (Ferris & Bongers, 2006). Según Zaki et al.
(2012), la tolerancia de los nematodos a la salinidad depende de la composición y concentración de sales en el perfil
del suelo. Estos autores también citan el efecto que generan las sales sobre algunos aspectos del ciclo de vida de los
nematodos fitófagos. En suelos salinos del Alto Valle de
Río Negro los nematodos Boleodorus y Paratylenchus resultaron tolerantes a la salinidad (Azpilicueta et al., 2013).
En la región del Alto Valle de Río Negro la fertilización
nitrogenada mineral es una práctica cultural habitual de los
productores frutícolas. El nitrógeno estimula el crecimiento de los cultivos, influye en la brotación, floración y en
la producción de frutas. Se ha demostrado que fertilizaciones minerales nitrogenadas en el suelo provocaron cambios en la estructura de la comunidad de nematodos (Azpilicueta et al., 2014). El agregado de dosis altas de nitrógeno, 600 kg N ha-1, redujo la población de nematodos omnívoros y depredadores, debido probablemente a la disminución del recurso alimenticio y a la acidificación del
suelo (Li et al., 2010). El enriquecimiento con nitrógeno
también afectaría negativamente la abundancia de nematodos bacteriófagos y fungívoros como consecuencia
de la disminución del pH del suelo (Chen et al., 2015).
Los índices de la comunidad de nematodos del suelo
proporcionan una medida del funcionamiento de la red trófica del suelo y estos índices se confeccionan de acuerdo
a las estrategias de vida de los nematodos ubicados en una
escala discreta colonizador-persistente (c-p) y a sus hábitos tróficos (Ferris et al., 2001). Así, el índice de enriquecimiento (EI) de la red trófica está basado en la sensibilidad que tienen los nematodos bacteriófagos oportunistas
a la disponibilidad del recurso y el índice de estructura (SI),
determinado por la población de nematodos omnívoros y
depredadores, informa sobre la complejidad y la capacidad
de supresión de plagas que tiene la red trófica del suelo.
El índice basal (BI) indica la predominancia de los grupos de
nematodos que son tolerantes a la perturbación del suelo
y el índice canal (CI), integra para su cálculo a los nematodos
oportunistas que responden rápidamente al enriquecimiento de nutrientes (Ferris et al., 2001). En el Alto Valle
del Río Negro, en suelos fertilizados, se encontraron redes
tróficas moderadamente enriquecidas y estructuradas en
el suelo (Azpilicueta et al., 2014). La información obtenida
a través de los índices EI y CI permite evaluar los niveles
de fertilidad del suelo, disponibilidad de nutrientes y la ruta
de descomposición de la materia orgánica del suelo (Ferris et al., 2001). Estos índices, en estos últimos años, fueron
los más frecuentemente utilizados en el campo del conocimiento de la ecología de nematodos del suelo (Powell,
2007).
El efecto a largo plazo de la fertilización mineral nitrogenada de los suelos sobre la estructura de la comunidad
de nematodos, en los sistemas agrícolas, está bien documentado (Liang et al., 2009; Li et al., 2010; Chen et al.,
2015). En el Alto Valle de Río Negro es escasa la información sobre la nematofauna en suelos salinos fertilizados
con nitrógeno, por ello, los objetivos del presente estudio
fueron: analizar el efecto de la fertilización nitrogenada,
en una cronosecuencia, sobre el ensamble de nematodos
en un suelo salino y evaluar la condición de la red trófica
del suelo por medio de los índices de la comunidad de
nematodos en un huerto frutícola.
MATERIALES Y MÉTODOS
Descripción del área y diseño experimental
En el Alto Valle de Río Negro se seleccionó un cuadro implantado con pera (Pyrus communis L.) cultivar Williams, en un
huerto comercial de 16 años, ubicado a 38º44‘07"S y 68º 08‘5,4"W. El monte fue conducido en espaldera en un marco
de plantación de 4 x 2 m. El material originario del suelo es aluvial,
el régimen de humedad corresponde al arídico y el de temperatura es térmico, lo que reflejan las condiciones de déficit hídrico durante todo el año (CIL, 1991). La precipitación media anual
es de 224 mm (datos de la estación meteorológica instalada
en la Facultad de Ciencias Agrarias, Universidad Nacional del
Comahue, período 1972-2010). El suelo de la parcela fue franco
limoso (28% de arcilla, 50% de limo y 22% de arena) y corresponde al orden Entisol, clasificado como Fluvacuente típico,
imperfectamente drenado.
El estudio se llevó a cabo a lo largo de una cronosecuencia
(S1, S2 y S3) que incluyó a los ciclos productivos 2008-2009, 2009-2010 y 2010-2011 con distintas dosis de fertilización. El plan de
manejo de la fertilización fue diseñado por el técnico encargado del huerto. Se fertilizó en todos los ciclos productivos con
sulfonitrato de amonio y nitrato de amonio en la fase del desarrollo y final del cultivo. La primera fase se extiende desde floración hasta alcanzar el máximo desarrollo de la canopia y el crecimiento acelerado del fruto y la segunda fase incluye desde
maduración del fruto hasta senescencia. En los ciclos productivos 2008-2009 y 2009-2010 se realizaron aplicaciones de nitrógeno cuya dosis total fueron de 776 kg N ha-1 y 375 kg N ha-1 respectivamente, repartidas una en octubre y una en noviembre, dos en diciembre, una en febrero y dos en abril. En el ciclo
2010-2011 la dosis total de nitrógeno aplicada fue de 80 kg N
ha-1, repartidas en dos veces, una en octubre y otra en abril.
Se realizaron cinco aplicaciones de herbicidas por ciclo productivo. En primavera se aplicó tres veces el herbicida dicloruro
de 1,1’-dimetil-4,4’-bipiridilo a 3-4 L ha-1, 276 g L-1 de índice activo (3-4 L ha-1) y dos aplicaciones en verano de glifosato 1,92 g
L-1 de índice activo (4 L ha-1 ).
El sistema de riego gravitacional fue por melga sin pendiente y sin desagüe al pie. Se realizaron entre seis a siete riegos
por ciclo productivo.
Muestreo de suelo
Se seleccionaron al azar siete plantas de pera. Se demarcó
alrededor de cada una de ellas el sitio experimental, que abarcó un área de 2 m2 conformado por una banda de 1 m a cada lado
del tronco del árbol sobre la fila de plantación y a 50 cm a cada
lado en sentido transversal a la fila. Se extrajeron 15 sub-muestras
de suelo y se conformó una muestra compuesta para la determinación de las propiedades físico-químicas y los nematodos
del suelo en cada sitio experimental, utilizando un barreno de
5 cm2 de área y de 0 a 20 cm de profundidad. Las muestras fueron
conservadas a 4 ºC hasta su procesamiento. Cada ciclo productivo se caracterizó con dos momentos de muestreo (primavera
y otoño). Las fechas de muestreo fueron el 14/11/08, 22/05/09,
3/12/09, 14/05/10, 10/11/10 y 26/4/11.
Propiedades físico-químicas del suelo
En las muestras de suelo se determinaron las siguientes
variables edáficas: pH medido en la pasta saturada (método
potenciométrico), conductividad eléctrica específica (CE),
cationes y aniones en el extracto de saturación: Na+, K+, Cl- y
SO4=, cationes intercambiables Na+ y K+ (método acetato de
NH4+), porcentaje de sodio de intercambio (PSI), materia orgánica del suelo (MOS) (Walkley & Black, 1934) y nitratos (N-NO3-). La concentración de nitratos se determinó mediante
un equipo de medición rápida (Merck reflectoquant), que expresa el resultado directamente en mg kg-1. Este valor se corrigió por la humedad del suelo al momento de la extracción.
Análisis e identificación de nematodos
Para la extracción de los nematodos se separó una alícuota de 100 g de suelo húmedo de cada muestra compuesta homogeneizada y se la procesó mediante la técnica de flotacióncentrifugación (Caveness & Jensen, 1955). La abundancia de
los taxones de nematodos se expresó por 100 g de suelo seco,
para ello se determinó la humedad del suelo gravimétricamente secando cada muestra a 105ºC, hasta peso constante.
Los taxa de nematodos fueron agrupados en los grupos tróficos
bacteriófagos (Ba), fungívoros (Fu), omnívoros (Om), carnívoros (Ca) y fitófagos (H) de acuerdo a Yeates et al. (1993).
Grupos funciones e índices de nematodos
La comunidad de nematodos presente en cada muestra
de suelo fue caracterizada a través de los grupos funcionales
e índices de la comunidad de nematodos. A cada taxa se le asignó un valor de c-p (colonizador-persistente) de 1 a 5, correspondiente a la posición a lo largo de un continuo colonizador-persistente
respecto a su fecundidad y características del ciclo de vida
(Bongers & Bongers, 1998). Los nematodos con valores de c-p
igual a uno presentan alta fecundidad, ciclo de vida corta, producen huevos pequeños y son tolerantes al disturbio, mientras
que los que presentan valores de c-p cinco tienen baja tasa de
reproducción, ciclo de vida más largo y son susceptibles al disturbio. Esta clasificación permitió asignar a los taxones en grupos funcionales: Bax, Fux, Omx, Cax, Hx donde x=1-5.
Los índices basal (BI), de enriquecimiento (EI) y de estructura (SI) fueron calculados de acuerdo a Ferris et al. (2001),
con los componentes basales (b) de la red trófica (Ba2 y Fu2)
calculado como b = ∑kbnb donde kb es el valor asignado para
el grupo funcional y n es el número de nematodos en aquel
grupo. Los componentes de enriquecimiento (e) y de estructura (s) fueron calculados en forma similar, utilizando a los grupos funcionales de nematodos Ba1 y Fu2 como indicadores de
enriquecimiento y a los grupos Ba3-5,
Fu3-5, Om3-5 y Ca2-5 como
indicadores de estructura de la red trófica. El índice EI se calculó como 100 x {e/(e+b)} y el índice SI como 100 x {s /(s+b)}.
El índice canal (CI) fue calculado como 100 x (0,8Fu2) /(3,2Ba1 + 0,8Fu2).
Determinación de rendimiento
El rendimiento total del cultivo fue determinado con la recolección total de frutos de cada uno de los siete árboles seleccionados. La cosecha fue realizada el 7 y 8 de enero 2009, 18
y 19 de enero 2010 y 10 y 11 de enero 2011, al momento de la
autorización oficial de cosecha de la variedad Williams (Fecha
de sello), publicado por la Secretaría Nacional de Agricultura.
La determinación del rendimiento total en kg pl-1 fue obtenida
por el peso individual de todos los frutos por árbol.
Análisis estadísticos
Las propiedades físico-químicas del suelo fueron analizadas ajustando modelos de análisis de varianza (ANOVA) para
estudiar la variabilidad entre las etapas de la cronosecuencia.
Cuando existieron diferencias, las medias fueron analizadas
según la prueba de Tukey, con un nivel de significación de 0,05,
utilizando el programa Infostat (Di Rienzo et al., 2013).
El Análisis Factorial Múltiple (AFM), (Escoffier & Pagés, 1994),
se estudió para analizar los grupos funcionales de nematodos
(Ba1-2, Fu2, Om4-5, Ca4 y H2-3) a través de la cronosecuencia. La
abundancia de los grupos de nematodos fue transformada como log (x+1), para el análisis estadístico. El análisis de las variables se basó en la interpretación de las dos primeras dimensiones del plano principal (Dim1 y Dim2) y fue realizado con
el paquete FactoMineR v.1.26 del software R v.3.1.0. La similaridad entre las etapas de la cronosecuencia se evaluó mediante
el cálculo del coeficiente RV (Escofier, 1973), y la representación de los grupos en el plano principal. Este coeficiente mide la relación entre dos conjuntos de variables. Si las variables de
un conjunto no tienen correlación con las del otro su valor será 0, mientras que si las configuraciones de los individuos inducidas
por los conjuntos de variables son homotéticas, su valor será 1.
La abundancia de nematodos fue analizada a través de un
modelo lineal generalizado (MLG) según el trinomio: componente aleatorio Binomial Negativa, función de enlace canónico
y componente sistemático constituido por la covariable cronosecuencia. Se realizó un análisis de correlación de Pearson para
cuantificar relación entre el contenido de N-NO3- en el suelo
y
la abundancia de nematodos Ba1 y Fu2. Los índices de la comunidad de nematodos del suelo y el rendimiento total del cultivo
fueron analizados ajustando modelos de análisis de varianza
(ANOVA) para estudiar la variabilidad en la cronosecuencia.
Cuando existieron diferencias, las medias fueron analizadas según la prueba de Tukey, con un nivel de significación de 0,05,
utilizando el programa Infostat (Di Rienzo et al., 2013).
RESULTADOS
Las variables edáficas que describen la salinidad del
suelo tales como conductividad eléctrica, cationes, aniones, porcentaje de sodio intercambiable y pH no variaron
con las dosis de nitrógeno aplicadas en los ciclos productivos (Tabla 1). Entre los aniones, predominó el SO4 = y los
valores fluctuaron entre 22,6 y 47,9 cmolc L-1; entre los
cationes predominó el sodio, variando entre 9,2 y 71,4
cmolc L-1. El valor promedio de pH fue de 7,64 (± 0,1).
Tabla 1. Valores de las variables físico-químicas (media ± EE) del suelo en la cronosecuencia (S1, S2 y S3).
Table 1. Values of the soil physical-chemical variables (mean ± SE) in the chronosequence (S1, S2 and S3).
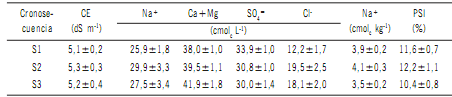
Cada media se obtuvo al promediar las siete repeticiones por dos fechas de muestreo (n=14) en cada etapa de la cronosecuencia. CE: conductividad eléctrica; Na+: sodio soluble (cmolc L-1); Ca+Mg: calcio + magnesio; SO4 =: sulfatos; Cl-: cloruros;
Na+: sodio de intercambio (cmolc kg-1); PSI: porcentaje de sodio de intercambio.
Each mean was obtained by averaging the seven replications per the two sampling times (n=14) in each stage of chronosequence.
CE: electrical conductivity; Na+: soluble sodium (cmolc L-1); Ca+Mg: calcium + magnesium ions; SO4 =: sulfate ions; Cl- :
chloride ions; Na+ sodium ions exchange (cmolc kg-1); PSI: exchangeable sodium percentage.
El contenido promedio de materia orgánica del suelo
fue de 4,0% (± 0,1) y el de N-NO3- de 29,5 mg kg-1 (± 3,0),
ambas variables no cambiaron en la cronosecuencia.
Las dos primeras dimensiones del AFM del ensamble
de nematodos explicaron el 39,1% de la variabilidad total
del sistema (Fig. 1A). En el plano principal del AFM, la configuración que surgió del conjunto de las variables biológicas mostró una clara separación entre las etapas de la cronosecuencia. Los valores del coeficiente de similitud RV
indicaron que el conjunto de las variables biológicas presentó mayor similitud entre las etapas S2 y S3 (0,56) que
entre S1 y S3 (0,42), y S2 y S1 (0,30) (Fig. 1B).
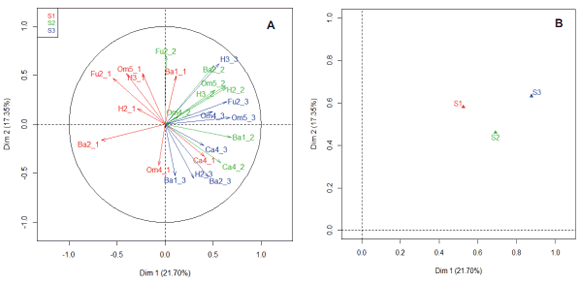
Figura 1. (A) Representación de las variables (grupos funcionales de nematodos) en el plano principal de las tres etapas de la cronosecuencia (S1,
S2 y S3). (B) Representación resumida de los grupos de variables. Ba1
: bacteriófagos c-p=1; Ba2
: bacteriófagos c-p=2; Fu2: fungívoros c-p=2; Om4:
omnívoros c-p=4; Om5
: omnívoros c-p=5; Ca4
: carnívoros c-p=4; H2
: fitófagos c-p=2 y H3
: fitófagos c-p=3. El primer número seguido de los grupos
funcionales indican los valores de c-p (Bongers & Bongers 1998; Ferris et al., 2001) y el segundo número indica la etapa en la cronosecuencia (1=S1,
2=S2 y 3=S3).
Figure 1. (A) Representation of the variables (nematode functional guilds) in the principal plane of three stages of the chronosequence (S1, S2 and
S3). (B) Synthetic representation of the groups of variables in the chronosequence. Ba1
: bacterivores c-p=1; Ba2
: bacterivores c-p=2; Fu2
: fungivores;
Om4
: omnivores c-p=4; Om5
: omnivores c-p=5; Ca4
: carnivores c-p=4; H2
: plant feeding nematodes c-p=2 and H3
: plant feeding nematodes c-
p3. The first number following of functional guilds indicate the c-p values (Bongers & Bongers 1998; Ferris et al., 2001) and the second number indicate
the stage in the chronosequence. (1=S1, 2=S2 and 3=S3).
En la cronosecuencia estudiada, la estructura de la comunidad de nematodos estuvo dominada por los nematodos fitófagos, que representaron entre el 43 y 53% del
total de los individuos. El grupo funcional H2 prevaleció y
el género Boleodorus fue el más abundante (Tabla 2). La
abundancia total de nematodos fue mayor en S1 (P <0,01),
debido al aumento de los grupos funcionales Ba1 y Fu2. La
abundancia de Ba1 y Fu2 fue cuatro y tres veces mayor en S1 respectivamente, respecto de S2 y S3. No se obtuvo
relación lineal entre el contenido de nitratos en el suelo y
la abundancia de nematodos Ba1 (r= -0,12; P= 0,45) y Fu2 (r= -0,14; P= 0,48). La densidad de Panagrolaimidae y
Rhabditidae fue mayor en S1 (P <0,01). El número de nematodos fitófagos, omnívoros y carnívoros no varió en la trayectoria de la sucesión. El índice EI fue mayor en S1 (P<0,01) mientras que los índices BI, SI y CI no variaron en
la cronosecuencia (P >0,05) (Tabla 3).
Tabla 2. Abundancia media ± estándar error de los taxa y grupos funcionales de nematodos por 100 g de suelo seco, en la
cronosecuencia (S1, S2 y S3).
Table 2. Mean abundance ± standard error of taxa and nematode functional guilds per 100 g dry soil in the chronosequence
(S1, S2 and S3).
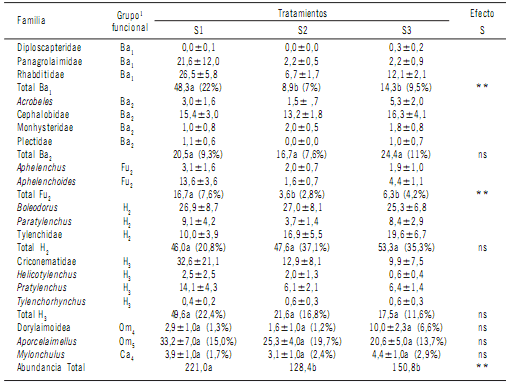
Cada valor se obtuvo de promediar las siete repeticiones por fecha de muestreo (n=14) en cada etapa de la cronosecuencia.
1Números seguidos
de los grupos funcionales indican los valores de c-p (Bongers & Bongers, 1998; Ferris et al., 2001). Los valores medios en la misma fila seguido
por la misma letra no son significativamente diferentes de acuerdo a la prueba Tukey; diferencias entre los tratamientos se indican como ns: P >0,05 y **: P <0,01. Los números entre paréntesis corresponden a los porcentajes de los grupos funcionales por tratamiento.
Each mean was obtained by averaging the seven replications per the two sampling times (n=14) in each stage of chronosequence.
1
Numbers
following of functional guilds indicate the c-p values (Bongers & Bongers, 1998; Ferris et al., 2001). Means within the same row followed by
the same letters are not significantly different according Tukey test; differences between treatments are reported as ns: P >0.05 and **:
P <0.01. The numbers in brackets correspond to percentages of nematode functional guild per treatment.
Tabla 3. Índices de la comunidad de nematodos en la cronosecuencia (S1, S2 y S3).
Table 3. Nematode community indices in the chronosequence (S1, S2 and S3).

Cada dato (media ± EE) fue obtenido al promediar siete repeticiones por dos fechas de muestreo (n=14) en
cada etapa de la cronosecuencia. EI: índice de enriquecimiento, BI: índice basal, SI: índice de estructura, CI: índice canal. Los valores medios dentro de la misma columna seguidos por la misma letra no son significativamente
diferentes de acuerdo a la prueba de Tukey.
Each data (mean ± SE) was obtained by averaging seven replications by two sampling times (n=14) in each
stage of chronosequence. EI: enrichment index, BI: basal index, SI: structure index, CI: channel index. Means
within the same column followed by the same letters are not significantly different according Tukey test.
El rendimiento total de frutos fue similar en la cronosecuencia (P > 0,05) (Fig. 2), siendo el peso promedio de
frutos de 38,7 kg por planta.
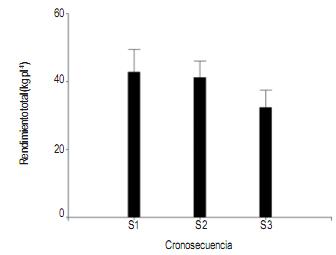
Figura 2. Rendimiento total de fruta por planta en la cronosecuencia
(S1, S2 y S3). El valor de la media fue obtenida al promediar
el peso de los frutos de siete plantas. Barras indican el error
estándar de la media.
Figure 2. Total yield of fruit per in the chronosequence (S1, S2 and S3).
Each mean was obtained by averaging the fruit weight of the
seven trees. Bars indicate standard error of the mean.
DISCUSIÓN
El suelo estudiado según Soil Survey Manual (1995),
es considerado ligeramente salino. Probablemente los
cambios de humedad del suelo debido al riego generaron
variaciones en la concentración salina de la solución del
suelo. Los valores más altos de CE fueron detectados en
primavera llegando hasta un valor de 8 dS m-1, que se
correspondieron con los valores más altos de PSI cercanos
a 14% al inicio del riego. Aruani et al., (2011) determinaron valores medios de CE de 20 dS m-1 en el horizonte subsuperficial de este suelo frutícola. La presencia de una capa
freática fluctuante a los 70 cm durante los ciclos del cultivo
provocó el ascenso capilar de las sales hacia el horizonte
superficial. Esta situación es frecuente encontrarla en los
suelos de Alto Valle de Río Negro.
La estructura de la comunidad de nematodos estuvo
dominada por nematodos fitófagos y representada en
particular por la familia Tylenchidae, que pueden constituir el 30% o más de individuos en una muestra (Ferris & Bongers, 2006). En este suelo salino la diversidad funcional de los nematodos fungívoros fue baja (Tabla 2) en
relación a los resultados obtenidos en suelos no salinos
del Alto Valle, fertilizados con nitrógeno mineral y con
similar clase textural (Azpilicueta et al., 2008 y 2014). Los
nematodos fungívoros se alimentan de hongos y por ello
están implicados indirectamente en la descomposición de
la MOS, la ausencia de algunos grupos funcionales podría
afectar la dinámica de los nutrientes y por consiguiente el
rendimiento de la planta (Setälä, 2002). La dosis de nitrógeno aplicada en el primer ciclo productivo produjo un
aumento en la abundancia total de nematodos del suelo
del 60% respecto a las otras etapas de la cronosecuencia,
explicada por las variaciones observadas en la abundancia
de los grupos funcionales Ba1 y Fu2. Las familias del grupo funcional Ba1, Panagrolaimidae y Rhabditidae, aumentaron en S1. El efecto positivo de la adición de nitrógeno sobre
estas familias de nematodos ha sido confirmado por otros
estudios (Ferris & Bongers, 2006). Los nematodos bacteriófagos aumentan el contenido de N-NO3- en el suelo
a través de sus excreciones y en consecuencia promueven
la mineralización del nitrógeno y la nitrificación (Xiao et
al., 2010). En nuestra investigación, con el régimen de
muestreo utilizado, no fue posible detectar cambios en el
contenido de N-NO3- que se correspondan con los cambios en la abundancia de nematodos microbívoros. Tampoco detectamos variaciones en el contenido de N-NO3- durante la cronosecuencia que se correspondan con el agregado de las dosis de nitrógeno. La magnitud del efecto de
la fertilización está limitada espacialmente y depende de
las dosis de nitrógeno aplicado y de la duración del tratamiento (Geisseler & Scow, 2014).
El aumento en la abundancia de los nematodos Ba1 y
Fu2 en la primera etapa de la cronosecuencia (S1), mencionado anteriormente, no se correspondió con lo reportado por Chen et al. (2015), quienes obtuvieron una reducción de los grupos tróficos bacteriófagos y fungívoros
como resultado de la acidificación del suelo con el agregado de altas dosis de nitrógeno. En nuestro estudio, la
fertilización nitrogenada no produjo variaciones en el pH
y se mantuvo ligeramente alcalino durante la cronosecuencia. La dominancia de arcillas esmectitas en nuestros
suelos (Apcarian et al., 2014) que presentan alta superficie específica y gran capacidad buffer, probablemente
hayan estabilizado el pH ante el agregado de fertilizantes
nitrogenados y de esta manera protegerían a la comunidad
microbiana frente a situaciones adversas, manteniendo el
recurso alimenticio en la red trófica del suelo (Neumann
et al., 2013).
El efecto de la manipulación del enriquecimiento de la
red trófica del suelo por el agregado de fertilizantes nitrogenados se demuestra a través del índice EI (Ferris et al.,
2001). Este índice fue mayor en la primera etapa de la cronosecuencia (EI: 78,6%) coincidiendo con el agregado de
la mayor dosis de nitrógeno. Comparando con resultados
obtenidos en la zona de Alto Valle, el valor de EI en S1 fue
superior a los encontrados en suelos no salinos fertilizados con nitrógeno durante 13 años consecutivos en plantaciones de frutales de pepita (Azpilicueta et al., 2011). Los
valores de CI fueron similares en la cronosecuencia estudiada (Tabla 3). Esto indicó que la ruta de descomposición
de la MOS estuvo dominada por el canal bacteriano en
relación al canal fúngico. Wichern et al. (2006) determinaron que los hongos son más sensibles a la salinidad que
las bacterias y la salinidad del suelo altera fuertemente los
procesos de recambio de la MOS. El contenido de materia
orgánica de estos suelos fue alto para la zona de Alto Valle
(Aruani et al., 2001) y se mantuvo constante e independiente de las dosis de nitrógeno aplicadas durante la sucesión. De la interpretación de los índices EI y CI en S1, se
deduce que la red trófica del suelo estuvo más enriquecida que en los restantes etapas de la cronosecuencia, y se
dieron las condiciones favorables para la descomposición
bacteriana de la MOS. Van Eekeren et al., (2009) encontraron una relación positiva entre la velocidad de crecimiento
bacteriano y la proporción de nematodos bacteriófagos.
El índice basal (BI) es un indicador de la prevalencia de
los nematodos oportunistas generalistas que toleran la
perturbación del suelo. Los bajos valores obtenidos de esteíndice (11,1%), indicaron que en el ensamble de nematodos, el número de individuos de niveles tróficos altos fue
relevante en relación al número de los nematodos tolerantes a la perturbación, principalmente los de niveles tróficos bajos. La abundancia de nematodos omnívoros y carnívoros no cambió en la trayectoria de la sucesión, en contraste con los resultados reportados por otros investigadores (Liang et al., 2009; Song et al., 2016). Entre los nematodos hallados con valor de c-p alto, predominó el omnívoro Aporcelaimellus y su abundancia no varió en este suelo salino. Este nematodo está ampliamente distribuido en diferentes tipos de suelo y presenta una gran adaptación a ambientes extremos (McSorley, 2012), además,
al intervenir en varios niveles de la red trófica podría desplazar a otros grupos tróficos de nematodos con un nicho
de amplitud estrecho (Hánl, 2010) y contribuir con el reciclado de nutrientes. El valor del índice SI es determinado
por la población de nematodos omnívoros y carnívoros, que al ser sensibles al disturbio necesitan mayor tiempo para recuperarse que los nematodos bacteriófagos y fungívoros.
En esta investigación el índice no cambió en la cronosecuencia y el valor promedio fue de 81,4%, lo que sugiere una estructura compleja de la comunidad con varias uniones en
la red trófica.
En cultivos anuales, el agregado de nitrógeno mineral
en suelos con niveles de salinidad entre 5 y 9 dS m-1 en su
fase inicial de crecimiento, fue ineficaz para contrarrestar
los efectos adversos sobre el crecimiento y el rendimiento
del cultivo causado por las sales (Hu & Schmidhalter, 2005).
En nuestro estudio, el rendimiento total del cultivo no
manifestó diferencias significativas en la cronosecuencia,
aunque, se obtuvo un leve incremento en S1 y S2 respecto
a S3 (Fig. 2). En otros investigaciones realizadas en la zona de Alto Valle con suelos de clase textural similar, no salinos y con fertilizaciones minerales nitrogenadas más bajas (150 kg N ha-1) se obtuvo un incremento del 20% en
los rendimientos (Aruani et al., 2014) respecto a nuestro
estudio. Probablemente el efecto de las sales comprometió la absorción de nitrógeno debido a la competencia entre los iones Cl- y NO3- en condiciones salinas (Gratta& Grieve; 1999, Chen et al., 2010).
CONCLUSIONES
En un suelo con salinidad media de 5,1 dS m-1 y fertilizado con distintas dosis de nitrógeno, el contenido de
materia orgánica del suelo, el pH del suelo y los rendimientos del cultivo no variaron en la cronosecuencia. El ensamble de nematodos fue distinto en la cronosecuencia. La
abundancia de los grupos funcionales de nematodos de
enriquecimiento Ba1 y Fu2 fue mayor en S1, coincidiendo
con el agregado de la mayor dosis de nitrógeno. La abundancia de los nematodos omnívoros y carnívoros no fue
alterada en la cronosecuencia. Los índices biológicos revelaron una red trófica moderadamente enriquecida y compleja. La interpretación de los índices de la comunidad de
nematodos asociada a las variables edáficas permitió y evaluar la condición de la red trófica de un suelo salino y fertilizado con nitrógeno.
BIBLIOGRAFÍA
1. Apcarian, A; PM Schmid, & MC Aruani. 2014. Suelos con acumulaciones calcáreas en el Alto Valle de Río Negro. Patagonia Norte. En: PA Imbellone. (ed) Suelos con acumulaciones calcáreas y yesíferas
de Argentina. Ediciones INTA. Buenos Aires. Argentina. Pp149-182.
2. Aruani, MC; E Sánchez; C Dussi & C Arjona. 2001. Micronutrientes
disponibles en suelos del Alto Valle de Río Negro, Argentina. AgroCiencia (Chile). 17(1): 23-28.
3. Aruani, MC; E Sánchez; PD Reeb & E Aun. 2007. Variación de la
concentración de nitratos en un suelo franco limoso del Alto Valle
de Río Negro. Revista Facultad de Ciencias Agrarias. Universidad
Nacional de Cuyo. Mendoza. Tomo XXXIX: 25-33.
4. Aruani, MC; N Barnes; G Striebeck; B Osre & Y Machuca. 2011. Physical
and physico-chemical properties of saline soils and effects on yield
and quality of pear var. Williams, in Upper Valley Rio Negro, Argentina. Acta Hortic. (ISHS). 909: 303-308.
5. Aruani, MC; PD Reeb & N Barnes. 2014. Influence of soil properties
on yield and fruit maturity at harvest of Williams pear. Chilean J.
Agric. Res. 74(4): 460-467.
6. Azpilicueta, CV; MC Aruani; PD Reeb & EE Sánchez. 2008. Estructura
de la comunidad de nematodos del suelo bajo dos niveles de fertilización nitrogenada en Alto Valle de Rio Negro, Argentina. Nematropica 38(1): 75-86.
7. Azpilicueta, CV; MC Aruani & E Chaves. 2011. Relación entre la nematofauna y la historia del manejo del suelo en huertos frutícola. Agro Sur 39(1): 13-23.
8. Azpilicueta, CV;
MC Aruani & E Chaves. 2013. Composition of plantfeeding nematodes in agricultural soils with different salinity levels.
XLV Annual Meeting. Organization of Nematologists of Tropical
America. Nematropica 43: 279. Abstract.
9. Azpilicueta, CV; MC Aruani; E Chaves & PD Reeb. 2014. Soil nematode
responses to fertilization with ammonium nitrate after 6 years
of unfertilized apple orchard. Span J. Agric. Res. 12: 353-363.
10. Bongers, T & M Bongers. 1998. Functional diversity of nematodes. Appl. Soil Ecol. 10: 239-251.
11. Caveness, FE & HJ Jensen. 1955. Modification of the centrifugal-flotation technique for the isolation and concentration of nematodes and their eggs from soil and plant tissue. Proceedings of
the Helminthological Society of Washington 22: 87-89.
12. Chen, W; Z Hou; L Wu; Y Liang & C Wei. 2010. Effects of salinity
and nitrogen on cotton growth in arid environment. Plant Soil
326(1): 61-73.
13. Chen, D; Z Lan; S Hu & Y Bai. 2015. Effects of nitrogen enrichment
on belowground communities in grassland: Relative role of soil
nitrogen availability vs. soil acidifisatioo. Soil Biol. & Biochem. 89:
99-108.
14. CIL (Consorcio Inconas Latinoconsult). 1991. Estudio para el Aprovechamiento Integral del Río Negro. Etapa II. Informe Edafológico,
Buenos Aires, Argentina. 643 p.
15. Di Rienzo, JA; F Casanoves; MG Balzarini; L Gonzalez; M Tablada & CW
Robledo. InfoStat versión 2013. Grupo InfoStat. FCA. Universidad
Nacional de Córdoba. Argentina.
16. Escofier, Y. 1973. Le traitement des variables vectorielles . Biometrics 25: 751-760.
17. Escofier, B & J Pagés (eds) 1994. Multiple factor analysis (AFMULT
package). Comput Stat Data Analysis 18: 121-140.
18. FAO (Food and Agriculture Organization). 2011. The state of the
words´s land and waters resources for food and agriculture (SOLAW).
Managing systems at risk. Food and Agriculture Organization of
the United Nations. Rome and Earthscan. London.
19. Ferris, H; T Bongers & RGM De Goede. 2001. A framework for soil
food web diagnostics: extension of the nematode faunal analysis
concept. Appl. Soil Ecol. 18: 13-29.
20. Ferris, H & T Bongers. 2006. Nematode indicators of organic
enrichment. J. Nematol. 38: 3-12.
21. Galeazzi, J & O Álvarez. 1998. Determinación de áreas afectadas por
niveles freáticos críticos en el Alto Valle de Río Negro. Congreso Latinoamericano y Argentino de Ingeniería Rural. La Plata-Argentina.
22. Geisseler, D & KM Scow. 2014. Long-term effects of mineral fertilizers
on soil microorganisms-A review. Soil Biol. & Biochem. 75: 54-63.
23. Grattan, SR & CM Grieve. 1999. Salinity-mineral nutrient relations
in horticultural crops. Sci. Hortic. 78: 127-157.
24. Hánel, L. 2010. An outline of soil nematode succession on abandoned
fields in South Bohemia. Appl. Soil Ecol. 46: 355-371.
25. Hu, Y & U Schmidhalter. 2005. Drought and salinity: A comparison
of their effects on mineral nutrition of plants. J. Plant Nutr. Soil
Sci. 168: 541-549.
26. Li, Q; Y Jiang; W Liang; Y Lou; E Zhang & C Liang. 2010. Long-term
effect of fertility management on the soil nematode community
in vegetable production under greenhouse conditions. Appl. Soil
Ecol. 46: 111-118.
27. Liang, W; Y Lou; Q LI; S Zhong; X Zhang & J Wang. 2009. Nematode
faunal response to long-term application of nitrogen fertilizer and
organic manure in Northeast China. Soil Biol. & Biochem. 41: 883-890.
28. McSorley, R. 2012. Ecology of the dorylaimid omnivore genera Aporcelaimellus, Eudorylaimus and Mesodorylaimus. Nematology 14(6): 645-663.
29. Neumann, D; A Heuer; M Hemkemeyer; R Martens & C Tebbe. 2013.
Response of microbial communities to long-term fertilization
depends on their microhabitat. FEMS Microbiol. Ecol. 86: 71-84.
30. Powell, JR. 2007. Linking soil organisms within food webs to ecosystem
functioning and environmental change. Adv. Agron. 96: 307-350.
31. Setälä, H. 2002. Sensitivity of ecosystem functioning to changes
in trophic structure, functional group composition and species
diversity in belowground food webs. Ecol. Res. 17: 207-215.
32. Skogerboe, GV. 1986. Riego, drenaje y salinidad en la Cuenca del río
Negro. En: Estudio para el aprovechamiento integral del río Negro,
C.I.L. Buenos Aires. Pp.1-14.
33. Soil Survey Manual. 1995. Handbook 18. United States Department
of Agriculture Soil Conservation Service, Washington D.C., USA.
336 pp.
34. Song, M; X Li; S Jing; L Lei; J Wang & S Wan. 2016. Response of soil
nematodes to water and nitrogen additions in an old-field grassland. Appl. Soil Ecol. 102: 53-60.
35. Van Eekeren, N; H de Boer; J Bloem; T Schouten; M Rutgers; R de
Goede & L Brussaard. 2009. Soil biological quality of grassland
fertilized with adjusted cattle manure slurries in comparison with
organic and inorganic fertilizers. Biol. Fertil. Soils. 45: 595-608.
36. Walkley, A & IA Black. 1934. An examination of Degtjareff method
for determining soil organic matter and a proposed modification
of the chronic acid titration method. Soil Sci. 34: 29-38.
37. Wichern, J; F Wichern & RG Joergensen. 2006. Impact of salinity
on soil microbial communities and the decomposition of maize
in acidic soils. Geoderma 137: 100-108.
38. Xiao, HF; B Griffiths; XY Chen; MQ Liu; JG Jiao; F Hu & H Li. 2010.
Influence of bacterial-feeding nematodes on nitrification and the
ammonia-oxidizing bacteria (AOB) community composition. Appl.
Soil Ecol. 45: 131-137.
39. Yeates, GW; T Bongers; RGM de Goede; DW Freckman & SS Georgieva.
1993. Feeding habits in soil nematode families and genera - An
outline for soil ecologists. J. Nematol. 25: 315-331.
40. Zaki, MJ; D Khan & M Abid. 2012. Nematodes in the saline
environment: a mini overview. Int. J. Biol. Biotech. 9: 99-113.




