TRABAJOS
Impacto de la aplicación prolongada de urea sobre bacterias nitritantes de
un Argiudol típico, Argentina
Mónica Fabiola Boccolini1*; Laura Ana Basile2; Cristian Román Cazorla1;
Carlos Martín Galarza1; Belén Conde1 & Eva Lucía Margarita Figuerola3
1 Estación Experimental Agropecuaria INTA Marcos Juárez
2 Instituto de Investigaciones Biotecnológicas-Universidad Nacional de San Martin
3 Instituto de Investigaciones en Ingeniería Genética y Biología Molecular ‘‘Héctor Torres’’
*Autor de contacto: boccolini.monica@inta.gob.ar
Recibido: 07-07-15
Recibido con revisiones: 13-10-15
Aceptado: 15-10-15
RESUMEN
La oxidación del amoníaco a nitrito constituye un paso crítico en el ciclo del nitrógeno (N) y es realizado por las bacterias oxidantes
del amoníaco (BOA) o Nitritantes. El manejo agrícola puede afectar la comunidad de las BOA a través del uso prolongado de
fertilizantes nitrogenados como la urea, cuya aplicación tiende a aumentar la acidez del suelo. El tamaño, actividad, composición
de las BOA y variables químicas de suelo fueron investigadas luego de 12 años de fertilizaciones con urea. El ensayo presenta un
diseño en bloques completos aleatorizados con tres repeticiones sobre un suelo Argiudol típico de Marcos Juárez, Sudeste de Córdoba,
Argentina. Los tratamientos fueron: A como control sin aplicación; B y C con 95 y 165 kg ha-1 de urea como fuente de N, respectivamente. Se realizaron dos muestreos: previo a la siembra y en postcosecha de maíz. Para la caracterización de la comunidad
de BOA se utilizaron los métodos del número más probable, shaken soil slurry, reacción en cadena de la polimerasa y electroforesis
en gel de gradiente desnaturalizante. La fertilización con urea disminuyó el pH del suelo, aumentó la abundancia y diversidad de
las BOA pero no produjo cambios significativos en la actividad nitrificante potencial. La estructura de la comunidad de las bacterias
nitritantes estuvo dominada por miembros del Grupo 3 de Nitrosospira en todos los tratamientos. Los resultados obtenidos indican
que la fertilización con urea a largo plazo en un Argiudol típico representó una fuente de sustrato más que un factor limitante
para las BOA. El efecto de la fertilización fue más evidente en el muestreo previo a la siembra de maíz.
Palabras clave: Fertilización nitrogenada; Propiedades químicas del suelo; Comunidad de bacterias oxidantes del amoníaco;
Electroforesis en gel de gradiente desnaturalizante.
Impact of the long application of urea on bacteria nitritantes of a typical
Argiudol, Argentine
ABSTRACT
Ammonia oxidation to nitrite is a critical step in the nitrogen (N) cycle and is performed by ammonia-oxidizing bacteria
(AOB) also called Nitrifying. Agricultural management can affect the AOB community due to the prolonged use of nitrogen
fertilizers such as urea which tend to increase soil acidity. After 12 years of urea application, size, activity, AOB composition
and chemical variables were investigated. The performed field experiment had a complete randomized block design with
three replicates on a typical Argiudol soil located in Marcos Juárez, Southeastern Córdoba, Argentine. The treatments were:
A control without N-application; B and C with 95 and 165 kg ha-1 of urea as the N source respectively. Soil samples were
collected before sowing and after corn harvest. The AOB community was studied through the most probable number method,
shaken soil slurry, polymerase chain reaction and electrophoresis in denaturing gradient gel. Urea fertilization decreased soil
pH, increased AOB abundance and diversity but did not significantly affect nitrifying potential. Bacterial community structure
was dominated by members of the Group 3 of Nitrosospira in all the treatments. The results showed that the long-term
urea fertilization in a typical Argiudol was a substrate source and not a limiting factor for the nitrifying bacteria. The fertilization
effect was more evident in the sampling date before corn sowing.
Key words: Nitrogen fertilization; Soil chemical properties; Community of ammonia-oxidizing bacteria; Denaturant gradient
gel electrophoresis (DGGE).
INTRODUCCIÓN
La nitrificación es el proceso final de la mineralización
de la materia orgánica nitrogenada (Orozco 1999, citado en
Miller Gallego, 2012) donde ocurre la oxidación biológica
del amoníaco (NH3) a nitrato (NO3-). Las bacterias oxidantes
de amoníaco (BOA), o nitritantes son microorganismos
quimioautótrofos que utilizan la oxidación de amoníaco
(NH3) a nitrito (NO2-) como fuente de energía, jugando un
rol fundamental en el ciclo del nitrógeno (N) en suelos. La
nitrificación genera el sustrato para los procesos de pérdidas
de N por lavado de NO3- y desnitrificación (Kowalchuk & Stephen, 2001) pudiendo tener efectos negativos para el
medio ambiente por ocasionar la contaminación del agua
subterránea o la generación de gases de efecto invernadero.
Las BOA conforman un grupo funcional utilizado frecuentemente como modelo en ecología microbiana para
estudiar el impacto de las actividades antrópicas sobre los
microorganismos del suelo (Noe & Abril, 2015; Enwall et al., 2007; Kowalchuk & Stephen, 2001). Si bien las arqueas
oxidantes de amoníaco (AOA) son también capaces de
llevar a cabo la oxidación del NH3, se considera que las BOA
demuestran una mayor respuesta a prácticas de fertilización nitrogenada en estudios a largo plazo con respecto a
las AOA (Shen et al., 2008; Ai et al., 2013).
Para caracterizar la estructura de la comunidad de bacterias nitritantes, los métodos moleculares, y en particular,
el análisis por electroforesis en gel de gradiente desnaturalizante, en inglés DGGE, ha sido ampliamente utilizado
en diferentes estudios, incluyendo suelos con manejo de
fertilización (Ai et al., 2013; Enwall et al., 2007; Nicolaisen & Ramsing, 2002).
La fertilización es mundialmente utilizada para aumentar el rendimiento de los cultivos, afectando las propiedades
bioquímicas y biológicas del mismo (Ai et al., 2013). En
particular, el uso de fertilizantes nitrogenados puede influenciar enormemente la disponibilidad de N
y el pH del suelo
(Ciarlo & Palma, 2011). La magnitud del efecto acidificante
por fertilización nitrogenada a largo plazo dependerá de
factores como el manejo de fertilización, tipo de suelo y clima
(Chien et al., 2008).
En suelos Argiudoles de la región Pampeana el elevado
contenido de materia orgánica del suelo (MOS), entre 2 y
4% y la saturación de bases en el complejo, superior al 50%,
permitirían atenuar el efecto acidificante de la aplicación
de fertilizantes nitrogenados debido a su capacidad buffer
(Iturri et al., 2010; González et al., 2011). En la zona este
de la provincia de Córdoba perteneciente a la región Pampeana Ondulada domina la actividad agrícola y el manejo
de fertilización depende de muchos factores, siendo el económico en términos de producción, el más importante (Lavado, 2010).
Es bien sabido que, los diferentes sistemas de labranza,
la fertilización mineral y los rastrojos de cultivos afectan
a la comunidad de BOA (Yu et al., 2010). Numerosos estudios a campo en diferentes suelos han estudiado el efecto de la aplicación prolongada de fertilizantes nitrogenados sobre la comunidad de las BOA y su estructura. El efecto
de la aplicación de fertilizantes nitrogenados sobre el pH
edáfico es determinante, debido a la implicancia de esta variable ambiental sobre la comunidad de BOA (Enwall et al.,
2007; Ward, 2008; Nicol et al., 2008)
Shen et al. (2008); Yu et al. (2010) y Ai et al. (2013) observaron que en suelos de textura fina ácidos o moderadamente ácidos y de textura gruesa alcalinos, el uso de urea
afectó positivamente a las BOA aumentando la abundancia
y diversidad con cambios en la estructura de la comunidad.
Mientras que, cuando se aplicó sulfato de amonio en suelos
ligeramente ácidos, los efectos sobre dicha comunidad fueron negativos (He et al., 2007; Enwall et al., 2007).
Hasta donde alcanza nuestro conocimiento, no se han
reportado trabajos que caractericen a la comunidad de
bacterias nitritantes en suelos con buena capacidad buffer
como los Argiudoles de la zona en estudio fertilizados con
urea a largo plazo.
El objetivo de este trabajo fue caracterizar la comunidad
de bacterias oxidantes del amoníaco en un ensayo de larga
duración, teniendo en cuenta los efectos del manejo de fertilización sobre las propiedades químicas del suelo y rastrojos.
MATERIALES Y MÉTODOS
Descripción del ensayo y diseño experimental
El trabajo se realizó en un ensayo establecido en 1993 en la
Estación Experimental Agropecuaria INTA Marcos Juárez (32º 41’ de latitud Sur y a 62º 7’ longitud Oeste) ubicado sobre un suelo
clasificado como un Argiudol típico de textura franco-limoso, con
un 3,26% de materia orgánica (MO) y N total de 1,8 g kg-1 de
suelo. El pH es de 6,4 clasificado como ligeramente ácido (González
et al., 2011); la CIC 19,3 cmolc kg-1 y una saturación de bases de
91% (INTA, 1978). La secuencia de cultivos usada en la rotación
es maíz-trigo/soja de segunda-soja de primera bajo siembra directa
continua. El diseño consistió en bloques completos aleatorizados
con tres repeticiones. Los tratamientos fueron: Control, sin aplicación de urea (A); con 90 (B) y 165 (C) kg ha-1 de N como urea
por año. Además se consideró una pastura natural como situación de referencia (SR). Se realizaron dos muestreos: previo a
la siembra de maíz (con rastrojo de soja1ra. en superficie) el 18/10/2010 y en postcosecha (con rastrojo de maíz) el 27/06/2011.
Recolección y acondicionamiento de las muestras
Las muestras de suelo fueron recolectadas de 0-10 cm de
profundidad con barreno 2,5 cm de diámetro tomando 30 submuestras por parcela conformando una muestra compuesta.
Conjuntamente se recolectaron rastrojos con aro de 21 cm de
diámetro juntando 6 submuestras por parcela para una muestra compuesta.
Las muestras de suelo húmedas fueron conservadas a 4 °C
hasta su procesamiento con tamiz de 2 mm. Las determinaciones
de abundancia de BOA, actividad o potencial de nitrificación de
suelo (PNS), contenido de N-NO3- (N de nitrato) y N-NH4+ (N
de amoníaco) fueron realizadas en húmedo, mientras que, las
determinaciones de MOS, pH, carbono (C) y N de la materia orgánica particulada (N-MOP) e incubación anaeróbica se realizaron con muestra seca. Además, se determinó el contenido de
humedad gravimétrica utilizando la densidad aparente de los primeros 10 cm de suelo. La extracción de ADN genómico se realizó a partir de suelo húmedo conservado a -20 ºC y las extracciones
fueron posteriormente almacenadas a la misma temperatura.
Las muestras de rastrojo fueron secadas en estufa a 60 ºC
por 48 h, pesadas, molidas y almacenadas hasta las determinaciones de C y N.
Determinaciones químicas
El contenido de C y N de los rastrojos se cuantificó mediante el método de Combustión en seco (Merry & Spouncer,
1998) con analizador LECO TrusPec CN.
El contenido de MO del suelo (MOS) se estimó a partir del
porcentaje de C orgánico (CO) (Gasparoni, 2008) mediante el
método titulométrico (Walkley & Black (1934). Para la determinación de la MOP, se realizó el fraccionamiento por tamaño de
partículas con tamiz de 106 µm según Cambardella & Elliott
(1992). Se determinó el contenido de C y N de la MOP siguiendo
el mismo procedimiento que para rastrojos.
Las mediciones de pH se realizaron de acuerdo a una relación suelo-agua de 1: 2,5 (IRAM, 29410. 1999). El contenido
de N-NO3- se determinó mediante el método del ácido Fenoldisulfónico (Bremner, 1965) y el de N-NH4+
por microdestilación
directa por arrastre de vapor (Keeney, 1982).
Determinaciones microbiológicas
El N potencialmente mineralizable del suelo proviene
principalmente de la fracción de MOP (Frabrizzi et al., 2003) y
su estimación se realizó a través del método de Incubación
anaeróbica de suelo (Echeverría et al., 2000). Dicho método
propuesto por Gianello & Bremner (1986), llamado N anaeróbico (Nan) consiste en la determinación de NH4+ producido luego de
una incubación de suelo durante siete días a 40 °C en anaerobiosis. La cantidad de NH4+ se cuantificó por microdestilación por arrastre de vapor (Keeney, 1982).
La abundancia de las BOA se estimó a través del método
de recuento del número más probable (NMP) (Alexander, 1965)
en medio líquido selectivo con (NH4)2SO4 y CaCO3 (Frioni, 2006).
Los medios fueron incubados durante 28 días a 29ºC. La actividad enzimática se determinó a través del potencial de nitrificación de suelo (PNS) por el método Shaken Soil Slurry según
(Drury et al., 2008). El contenido de NO3- generado
en intervalos de tiempo a las 0, 2, 6, 12, 22 y 24 h se cuantificó con el método
del ácido Fenoldisulfónico. La tasa de nitrificación fue determinada por regresión lineal de las concentraciones de N-NO3- en
el tiempo (h) y la pendiente fue utilizada para determinar el
PNS por día (d).
Amplificación por reacción en cadena de la
polimerasa (PCR) y electroforesis
La extracción de ADN se realizó a partir de 0,5 g de suelo
con kit Fast DNA SPIN para suelo (MP Biomedicals). La calidad
del ADN extraído se verificó mediante electroforesis en agarosa al 1% y la concentración mediante mediciones de absorbancia a 260 nm. Para la amplificación específica del gen 16S
ARNr de las BOA se realizó una nested-PCR (Zhang et al., 2010a
citado en Ai et al., 2013). En la primera amplificación se utilizaron primers específicos para las BOA, CTO F189 y R654 que
amplifican una región de 465 pb (Kowalchuck et al., 1997). El
producto generado fue utilizado como templado para la segunda amplificación con los primers F341-GC y R534 (Muyzer et al., 1993). Las condiciones de amplificación fueron según
(Muyzer et al., 1993). Todos los productos PCR fueron chequeados
en agarosa al 1% para verificar su tamaño y calidad. Posteriormente, los amplicones fueron separados por DGGE. Se prepararon geles de poliacrilamida al 8% conteniendo un gradiente
lineal desnaturalizante de 35 a 60% (donde el 100% de desnaturalizante contiene urea 7M y formamida 40% v/v). Luego
se sembraron 38 μL del producto de PCR por calle. Las condiciones de electroforesis fueron a 60 V durante 16 h a 60 °C. Los
geles fueron teñidos con GelRed en TAE 1X durante 30 min y
visualizados bajo luz UV. Los perfiles DGGE fueron digitalizados
y analizados con el software Gel Compare II (Applied Maths).
La posición y la intensidad de las bandas fueron utilizadas para
el cálculo de diversidad de las muestras (mediante el índice de
Shannon-Weaver (H’)) y análisis de conglomerados (AC).
Secuenciación y análisis filogenético
Las bandas más destacables en cuanto a la aparición e
intensidad en los tratamientos en el DGGE, fueron aisladas,
reamplificadas y sus productos fueron secuenciados. Las secuencias fueron comparadas con las existentes en la GenBank
database del National Center for Biotechnology Information (NCBI) usando el algoritmo BLAST. A partir del alineamiento
se construyó un árbol filogenético con el método de Máxima
Verosimilitud y el modelo de sustitución Kimura 2 (Kimura et al., 1980) del software Mega (Tamura et al., 2013). La evaluación estadística de la topología obtenida se realizó mediante
un análisis de bootstrap (100 réplicas).
Análisis estadístico de los datos
Para el análisis estadístico de los datos químicos y biológicos se utilizó el programa INFOSTAT (Di Rienzo et al., 2014).
Se aplicó un Modelo Lineal Mixto, tomando como efecto fijo
los tratamientos de fertilización y como efectos aleatorios, las épocas de muestreo y repeticiones de campo. Cuando existieron diferencias significativas en las variables medidas se realizó la prueba de comparación de medias mediante LSD Fisher
con significancias del 5%. Las correlaciones entre las variables
químicas y biológicas se obtuvieron mediante el Índice de
Pearson. Para garantizar la independencia de los datos, las correlaciones fueron realizadas en cada muestreo por separado.
Se informan sólo aquellas consistentes en ambas fechas y
estadísticamente significativas. Además, el análisis de correlación de Pearson también fue aplicado para estudiar la relación entre el pH y las bandas estudiadas. La SR no se incluyó en
los análisis estadísticos.
RESULTADOS
Propiedades químicas de los rastrojos y suelo
La fertilización prolongada con urea incrementó
significativamente (P<0,05) la cantidad de rastrojos y de MOS. No se detectaron diferencias (P>0,05) en la cantidad
de MOP (Tabla 1). El contenido de Nan disminuyó a medida que se incrementó la cantidad de urea aplicada, siendo
significativas sólo las diferencias entre el control y la dosis
mayor (P<0,05). El pH del suelo también disminuyó en
respuesta al agregado de fertilizante, presentando diferencias significativas entre dosis (P<0,05) (Tabla 1). Los contenidos de N-NH4+ y N-NO3- del suelo también fueron
afectados (P<0,05); el N-NH4+ fue 22% mayor en B con
respecto al A, mientras que C no se diferenció de A y B. El
contenido de N-NO-3 aumentó un 27% en C con respecto
al tratamiento A, el que a su vez no se diferenció significativamente de B (Tabla 1).
Tabla 1. Cantidad y calidad de rastrojos de cosecha; MOP (Materia Orgánica Particulada); MOS (Materia Orgánica de Suelo); Nan (Nitrógeno anaeróbico);
acidez del suelo (pH); N-NO3- ; N-NH4+ en los tratamientos: A (Sin N); B (90 kg N ha-1) y C (165 kg N ha-1). SR: Situación de Referencia. Dichos valores
fueron estimados por Modelo Lineal Mixto considerando a los muestreos como un factor aleatorio.
Table 1. Quantity and quality of crop residues; MOP (Particulate Organic Matter); MOS (Soil Organic Matter); Nan
(anaerobic nitrogen); soil acidity (pH); N-NO3- and N-NH4+ under treatments: A (without N); B (90 kg N ha-1) and C (165 kg N ha-1). SR: Reference soil.
These values were estimated by linear mixed model considering the sampling as a random factor.
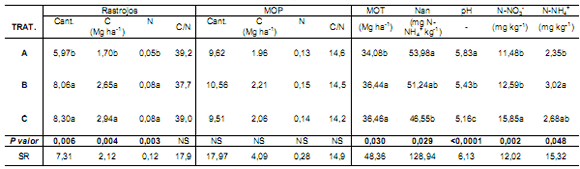
Letras distintas indican diferencias significativas (P< 0,05) según LSD de Fisher.
Letters refer to significant differences (P < 0,05) by Fisher LSD.
Abundancia, diversidad de
la comunidad de las BOA
y actividad potencial
La abundancia de BOA fue afectada significativamente
(P<0,05) por la aplicación de urea, aunque no hubo diferencias entre dosis. El NMP de BOA incrementó un 12%
en el tratamiento B y un 10% en tratamiento C con respecto al control A (Tabla 2). También la diversidad de BOA
fue significativamente mayor (P<0,05) en los fertilizados.
No obstante, el análisis del PNS indica una tendencia
decreciente con la dosis de urea que no resultó significativa (P>0,05) (Tabla 2).
Tabla 2. Valores de abundancia y diversidad (H’) de BOA y potencial de
nitrificación de suelo (PNS) con el error estándar en los diferentes tratamientos de fertilización y SR (Situación de Referencia).
Table 2. Abundance and diversity values (H’) of BOA and Soil Nitrification
Potential (PNS) and standard error in different fertilization treatments and
SR (Soil of Reference).
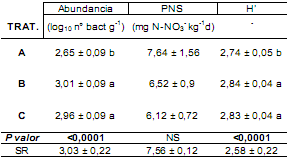
Letras distintas indican diferencias significativas (P< 0,05) según LSD de Fisher.
Letters refer to significant differences (P < 0,05) by Fisher LSD.
Correlaciones entre las propiedades químicas
y las BOA
El análisis del coeficiente de correlación de Pearson
mostró la existencia de correlaciones positivas y significativas entre H’ y el N de la MOP en ambos muestreos;
detectándose una correlación con un R2 = 0,75; P= 0,02
en presiembra y un R2 = 0,89; P= 0,001 en postcosecha.
Estructura de la comunidad de las BOA
La estructura de la comunidad fue caracterizada por
DGGE. El análisis se realizó por separado para cada muestreo
ya que las muestras correspondientes fueron corridas en sendos geles. Los perfiles de banda variaron entre tratamientos en ambos muestreos. En presiembra (Fig. 1a), la fertilización provocó un aumento en la riqueza y cambios en la
intensidad de las bandas del DGGE. Las bandas 2, 10 y 11
fueron exclusivas de los tratamientos con fertilización;
mientras que dos bandas (8 y 14) fueron propias del control.
Adicionalmente, se detectaron diferencias en la intensidad
de algunas bandas entre el control y los tratamientos. Las
bandas 3, 4, 12 y 16 fueron más intensas en B y C, mientras
que las bandas 7 y 19 presentaron un comportamiento
opuesto. El test de Pearson reveló correlaciones negativas
entre la abundancia de las bandas 2 y 16 con el pH (R2 = -
0,81; P= 0,004; R2 = -0,76; P= 0,001, respectivamente);
mientras que con la banda 19 la correlación con el pH fue
positiva (R2 = 0,91; P= 0,0001) indicando que a medida que
disminuye el pH también lo hace esta población de BOA.
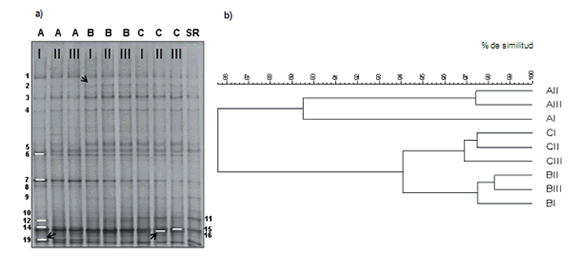
Figura 1. DGGE de BOA correspondiente al primer muestreo (presiembra de maíz) para los diferentes tratamientos de fertilización A: Sin N; B y C:
con 90 y 165 kg N ha-1 respectivamente y SR: Situación de Referencia (a); y Dendrograma de similitud (UPGMA y Coef. Correlación Pearson, expresado
en porcentaje) (b). Las líneas blancas señalan las bandas secuenciadas y las fechas negras aquellas que correlacionan con el pH. Los números romanos
representan las tres repeticiones de campo para cada tratamiento.
Figure 1. DGGE of BOA for the first sampling (prior to sowing of corn) with different fertilization treatments A: without N.; B and C: 90 and 165 kg N
ha-1 respectively and SR: Reference soil (a); and Dendrogram similarity (UPGMA and Correlation Coefficient of Pearson, expressed in percentage) (b).
The white lines indicate the bands sequenced and black arrows indicate bands correlating with pH. Roman numerals denote the three field replicates
for each treatment.
En postcosecha, se detectó menor variación en los perfiles entre los tratamientos evaluados (Fig. 2a) mostrando
que la composición de la comunidad de BOA fue muy similar. Los resultados son confirmados por los dendrogramas
de similitud del AC (Figs. 1b y 2b). En presiembra el tratamiento A se separó de B y C a un 85,1% de similitud. A su
vez dentro de los fertilizados hubo discriminación entre dosis
de fertilización. Por otra parte, en postcosecha, la estructura de las BOA presentó mayor similitud (93,5%) entre
los patrones con respecto a presiembra, sin embargo, la variación estructural se mantuvo, mostrando la separación
de B y C con respecto al tratamiento A.

Figura 2. DGGE de BOA correspondiente al segundo muestreo (postcosecha de maíz) para los diferentes tratamientos de fertilización A: Sin N; B y
C: con 90 y 165 kg N ha-1 respectivamente y SR: Situación de Referencia (a); y Dendrograma de similitud (UPGMA y Coef. Correlación Pearson, expresado
en porcentaje) (b). Los números romanos representan las tres repeticiones de campo para cada tratamiento.
Figure 2. DGGE of BOA for the second sampling (after harvesting of corn) in different fertilization treatments A: without N.; B and C: 90 and 165 kg
N ha-1 respectively and SR: Reference soil (a); and Dendrogram similarity (UPGMA and Correlation Coefficient of Pearson, expressed in percentage)
(b). Roman numerals denote the three field replicates for each treatment.
Las bandas 6, 7, 12, 14, 15, 16 y 19 fueron seleccionadas del DGGE (Fig. 1a) y secuenciadas para determinar su identidad y relaciones filogenéticas. El análisis reveló que
dichas secuencias presentaron elevados porcentajes de
identidad con cepas de las especies Nitrosospira tenuis, Nitrosospira multiformis mientras que dos fueron afines
a secuencias de clones de β Proteobacterias oxidantes del
amoníaco no cultivables (Tabla 3). Los perfiles DGGE estuvieron dominados por miembros del género Nitrosospira siendo la mayoría clasificadas como miembros del
Grupo 3 de Nitrosospira (Fig. 3). No se detectaron afiliaciones filogenéticas con el género Nitrosomonas.
Tabla 3. Bandas de BOA recortadas del DGGE, secuencias conocidas de mayor similitud en el Gen Bank, porcentaje de similitud y origen de las mismas.
Table 3. AOB DGGE bands with closest matches in Gen Bank percentages of similarity, and sources of origin.

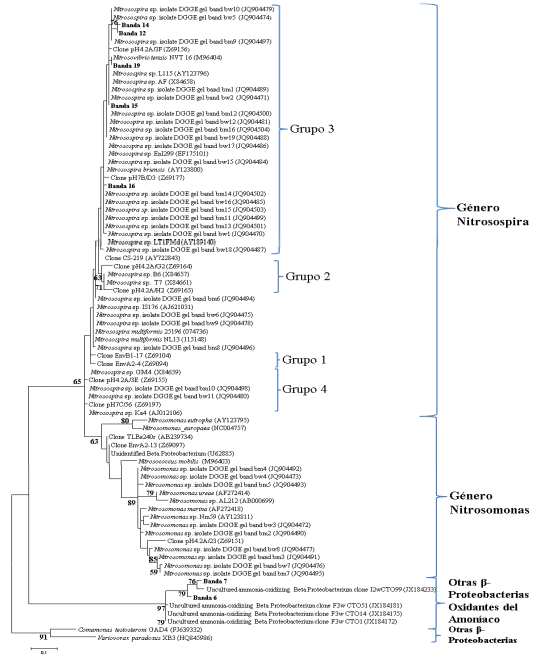
Figura 3. Árbol filogenético de las secuencias parciales del ADNr 16S de BOA, correspondientes a las bandas seleccionadas del DGGE y las secuencias
con mayor similitud obtenidas de GenBank. Las secuencias correspondientes a este estudio se muestran en negrita. La escala indica % de sustituciones.
Los valores bootstrap se muestran en los nodos.
Figure 3. Phylogenetic tree of partial AOB 16S rDNA sequences of DGGE selected bands in relation to 16S rDNA sequences of the closest uncultured
and cultured relatives from genbank. Band sequences from this study are labeled in bold. The scale bar indicates % nucleotide substitutions. Bootstrap
values are reported at the nodes.
DISCUSIÓN
La aplicación de urea a largo plazo en un suelo Argiudol
típico incrementó la abundancia y diversidad de las BOA
en relación al tratamiento sin fertilizar, demostrando que
el N aportado es un factor preponderante como sustrato
frente a la acidificación causada por la fertilización.
El pH disminuyó en los tratamientos con urea en forma similar a lo informado en otros trabajos (Fabrizzi et al.,
1998; Divito et al., 2011; Wyngaard et al., 2012). Sin
embargo, la abundancia, diversidad de las BOA y el potencial de nitrificación del suelo no fueron afectados negativamente por la acidificación del suelo. Esto concuerda con
datos bibliográficos de suelos ligeramente ácidos y alcalinos
donde se observó mayor abundancia (Biederbeck et al.,
1995; Chu et al., 2008; Shen et al., 2008) o un incremento
en la diversidad de BOA (Chu et al., 2007; Yu et al., 2010;
Ai et al., 2013) al aplicar urea a largo plazo a pesar de la
disminución en el pH edáfico.
Según Frioni (2006) el proceso de nitrificación se ve
favorecido debido al elevado aporte de N por fertilización
nitrogenada. En este estudio, el incremento de N aportado
quedó demostrado por el mayor contenido de N-NH4+ detectado en las parcelas con aplicación de urea. El mismo
resultado fue observado por Chen et al. (2011) y Yu et al. (2010) en ensayos de larga duración. El aumento N mineral encontrado en los tratamientos fertilizados, podría
derivar tanto del aporte del fertilizante, como así también
del mayor aporte por mineralización de los rastrojos, producto del incremento en el rendimiento agrícola asociado
a la fertilización (Diovisalvi et al., 2008). Según Nieder et al. (2010), además de los fertilizantes, los rastrojos de
cultivos y MOS afectan la concentración de N-NH4+ en la
solución del suelo.
En coincidencia con estudios previos en ensayos con
fertilización nitrogenada a largo plazo (Divito et al., 2011; Gregorutti et al., 2014), los tratamientos con urea generaron una disminución significativa del Nan, que representa
una medida del N potencialmente mineralizable (Echeverría et al., 2000; Fabrizzi et al., 2003). Este efecto se atribuye
a un aumento en la velocidad de mineralización de la MOP
como consecuencia de la aplicación de N (Galantini et al.,
2008). No se detectó relación entre el N potencialmente
mineralizable y las BOA, pero sí se observaron correlaciones positivas y significativas entre la diversidad de BOA con
el N de la MOP, indicando que posiblemente a partir de su
mineralización por microorganismos heterótrofos, actuaría favoreciendo a la comunidad nitrificante.
La concentración de N-NO3- aumentó en los tratamientos con urea al igual que en otros trabajos de fertilización nitrogenada a largo plazo (He et al., 2007; Chu etal., 2007; Shen et al., 2008; Yu et al., 2010), pero la actividad nitrificante potencial no fue afectada. Resultados
similares fueron publicados por Yu et al. (2010) al comparar suelos fertilizados con urea y un control sin fertilizar
en ensayos de larga duración.
A pesar de no haberse detectado cambios significativos en el PNS, este mostró una tendencia decreciente que
podría estar relacionada con la disminución del pH. La acidificación del suelo no afectó en forma negativa la abundancia y diversidad, pero es posible que haya generado una
selección de especies tolerantes o acidofílicas. Ha sido demostrado que las especies de BOA capaces de crecer en
condiciones ácidas poseen una ureasa intracelular que les
permite tomar urea directamente del medio, superando de
esta manera el inconveniente de la protonación del amoníaco a pH bajos (Burton & Prosser, 2001; Pomme-rening-Röser & Koops, 2005). Esta capacidad les permite competir
exitosamente en su ambiente, sin embargo, es posible que
tengan una menor velocidad de oxidación dando lugar a un
menor potencial de nitrificación en condiciones in vitro.
Las correlaciones observadas entre algunas poblaciones de
BOA y el pH reflejarían su adaptación o la falta de competitividad frente a la acidez del suelo. En forma similar, la selección de distintos linajes de BOA a lo largo de un gradiente
de pH fue observada anteriormente por Nicol et al. (2008),
y podría explicarse de acuerdo a Pommerening-Röser & Koops (2005) por los diferentes pHs óptimos para el transporte de urea de las distintas poblaciones.
La sensibilidad de la comunidad de las BOA frente a la
aplicación de urea fue demostrada por los dendrogramas
de similitud. Dicho análisis reveló que la estructura de la
comunidad de las BOA fue afectada por la fertilización en diferente magnitud de acuerdo a la época de muestreo. En
presiembra, en los tratamientos fertilizados se observó un
patrón de bandas más diverso con respecto al control,
mientras que en postcosecha las diferencias fueron menores. Otros trabajos obtuvieron resultados similares a los
observados en presiembra, donde la fertilización con urea
a largo plazo aumentó no sólo la intensidad de bandas con
respecto al testigo sino que además incrementó el número
de bandas o riqueza en el perfil DGGE (Shen et al., 2008;
Yu et al., 2010; Ai et al., 2013). A su vez en presiembra se
observa una separación específica a nivel de dosis, mientras que en postcosecha la misma no es evidente. Estas
diferencias entre muestreos, podrían ser explicadas por la
disponibilidad diferencial de N. En presiembra las condiciones de mayor mineralización de N determinadas por el
rastrojo de soja estimularían cambios más evidentes en la
composición de BOA; mientras que en postcosecha la presencia de rastrojo de maíz favoreció la inmovilización de
N, lo cual está asociado al cese de la actividad microbiana
(Ernst, 2002). A su vez, Wright et al. (2005) observaron
una fuerte influencia de especies de plantas y residuos de
cosecha sobre la diversidad microbiana del suelo. Si bien
el diseño de los muestreos en el presente trabajo no permite asegurarlo, sería interesante determinar si estas diferencias se deben a los rastrojos presentes en superficie
o a factores climáticos o estacionales, ya que ha sido demostrado en distintos ambientes que las BOA presentan
un comportamiento estacional (Taylor et al., 2012; Bouskill et al., 2011).
Las poblaciones dominantes se afiliaron filogenéticamente al Grupo 3 de Nitrosospira comúnmente detectado
en ambientes terrestres principalmente en suelos agrícolas (Kowalchuck & Stephen, 2001). La detección del género Nitrosospira y la ausencia de Nitrosomonas es consistente con otras investigaciones (Kowalchuck et al., 1997;
Chu et al., 2007; Yu et al., 2010) que señalan la dominancia de Nitrosospira en suelos. Más allá de que algunos trabajos han encontrado que la aplicación de fertilizantes nitrogenados a largo plazo promueve la dominancia del Grupo
3 de Nitrosospira (He et al., 2007; Yu et al., 2010), en este
estudio las poblaciones afiliadas al Grupo 3 fueron detectadas también en el control sin aplicación de N. De acuerdo
con lo observado por Chu et al. (2007) en tratamientos con
y sin aplicación de urea a largo plazo, y por Avrahami et al.
(2003) dicho grupo no necesariamente es dominante en
condiciones de elevada concentración de amonio y fue encontrado tanto en suelos fertilizados como en controles sin aplicación de N.
La elevada versatilidad de las BOA pertenecientes al
Grupo 3 (Avrahami et al., 2003) se ve reflejada en su ubicuidad en distintos tipos de suelos (Fierer et al. 2009 citado
en Glaser et al., 2010). La presencia de poblaciones con
elevada similitud a clones de Nitrosospira no cultivables
obtenidos de estanques mineros (Sow et al., 2014), estaría relacionada con esta característica general de las BOA
(Hiorns et al., 1995; Kowalchuck & Stephen, 2001).
Nuestros resultados demuestran que el manejo de
fertilización con urea a largo plazo en un suelo Argiudol
típico de la Argentina no produjo efectos negativos sobre
la comunidad de BOA, las que a su vez respondieron con
cambios en la abundancia y estructura demostrando su
sensibilidad al manejo agrícola.
CONCLUSIONES
La fertilización nitrogenada prolongada con urea aumentó el aporte de rastrojos y MOS, pero no generó cambios en la materia orgánica particulada. No obstante, a partir
de la mineralización, el N de dicha fracción podría actuar
como sustrato para los microorganismos nitrificantes del
suelo. La disminución del pH edáfico, no afectó negativamente a la comunidad de nitritantes. La urea representó una fuente de sustrato a partir del aporte de N, aumentando la abundancia y diversidad de las BOA. La actividad nitrificante potencial no reflejó estos cambios, sin embargo,
el contenido de nitrato fue mayor en los tratamientos con
aplicación. La estructura de la comunidad de BOA mostró cambios en respuesta a la fertilización y estuvo dominada
por miembros del Grupo 3 de Nitrosospira.
AGRADECIMIENTOS
Los resultados presentados en este trabajo son parte
de la Tesis de Maestría de la primera autora, en el Programa de Postgrado en Ciencias Agropecuarias de la
Facultad de Ciencias Agropecuarias, Universidad Nacional de Córdoba. La primera autora desea expresar un
profundo agradecimiento a la Dra. María Basanta y Ms.
Laura Torres por el asesoramiento y colaboración en la redacción de este trabajo. Este estudio fue financiado por los
Proyectos Específicos AEBIO 242441 (2010-2013) y PNS
1134043 de INTA. ELMF es miembro de la carrera de investigador científico de CONICET.
BIBLIOGRAFÍA
1. Ai, C; G Liang; J Sun; X Wang; P He & W Zhou. 2013. Different roles
of rhizosphere effect and long-term fertilization in the activity and
community structure of ammonia oxidizers in a calcareous fluvoaquic soil. Soil Biol. & Bioch. 57: 30-42.
2. Alexander, M 1965. Most-probable number method for microbial
populations. In: Black, CA (ed.). Methods of soil analysis. Am. Soc.
Agron. Madison. Pp. 1467-1472.
3. Avrahami, S; W Liesack & R Conrad. 2003. Effects of temperature
and fertilizer on activity and community structure of soil ammonia
oxidizers. Environ. Microbiol. 5: 691-705.
4. Biederbeck, VO; CA Campbell; H Ukrainetz; D Curtin & OT Bouman.
1995. Soil microbial and biochemical properties after ten years of
fertilization with urea and anhydrous ammonia. Can. J. Soil Sci.
76: 7-14.
5. Bremner, JM. 1965. Inorganic Forms of Nitrogen. In: Evans, DD; JL
White; LE Ensminger & FE Clark (eds). Methods of Soil Analysis.
Part 2. Chemical and Microbiological Properties. Am. Soc. of Agron.
Madison, USA. Pp. 1179-1232.
6. Bouskill, NJ; D Eveillard; GO Mullan; GA Jackson & BB Ward. 2011.
Seasonal and annual reoccurrence in Beta Proteobacterial ammonia-oxidizing bacterial population structure. Environ. Microbiol.
13(4): 872-886.
7. Burton, SA & JL Prosser. 2001. Autotrophic ammonia oxidation at low
pH through urea hydrolysis. Appl. Environ. Microbiol. 67: 2952-2957.
8. Cambardella, CA & ET Elliott. 1992. Particulate organic matter changes
across a grassland cultivation sequence. Soil Sci. Soc. Am. J. 56:
777-783.
9. Chantigny MH; DA Angers; T Morvan & C Pomar. 2004. Dynamics
of pig slurry nitrogen in soil and plant as determined with N-15. Soil Sci. Soc. Am. J. 68: 637-643.
10. Chien, SH; MM Gearhart & DJ Collamer. 2008. The Effect of Different
Ammonical Nitrogen Sources on Soil Acidification. Soil Sci. 173(8):
544-551.
11. Chu, H; T Fujii; S Morimoto; X Lin; K Yagi; J Hu & J Zhang. 2007.
Community structure of ammonia-oxidizing bacteria under longterm application of mineral fertilizer and organic manure in a sandy
loam soil. Appl. Environ. Microbiol. 73: 485-491.
12. Ciarlo, EA & M Palma. 2011. Nitrógeno del suelo. En: Conti, ME & L Giuffré, (eds). Edafología, bases y aplicaciones ambientales Argentinas. 1ra edn. Editorial Facultad de Agronomía. Univ. Bs. As.,
Argentina. Pp. 363-384.
13. Di Rienzo, JA; F Casanoves; MG Balzarini; L Gonzalez; M Tablada & CW
Robledo InfoStat Versión 2014. Grupo InfoStat, FCA, Universidad
Nacional de Córdoba, Argentina. URL http://www.infostat.com.ar.
14. Diovisalvi, NV; GA Studdert; GF Domínguez & MJ Eiza. 2008. Fracciones de carbono y nitrógeno orgánicos y nitrógeno anaeróbico
bajo agricultura continua con dos sistemas de labranza. Ci. Suelo
26(1): 1-11.
15. Divito, AG; HR Sainz Rozas; HE Echeverría; GA Studdert & N Wyngaard.
2011. Long term nitrogen fertilization: Soil property changes in
an Argentine an Pampas soil under no tillage. Soil Till. Res. 114:
117-126.
16. Drury, CF; SC Hart & XM Xang. 2008. Nitrification Techniques for
Soil. In: Carter, MR & EG Gregorich (eds). Soil sampling and methods
of analysis. 2da.
edn. Canadian Society of soil Science, CRC Press,
Taylor & Francis Group. New York, United States of America. Pp.
495-515.
17. Echeverría, HE; NF San Martín & R Bergonzi. 2000. Métodos rápidos
de estimación de nitrógeno potencialmente mineralizable en
suelos. Ci. Suelo 18: 9-16.
18. Enwall, K.; K Nyberg; S Bertilsson; H Cederlund; J Stenström & S Hallin.
2007. Long-term impact of fertilization on activity and composition of bacterial communities and metabolic guilds in agricultural soil. Soil Biol. & Bioch. 39: 106-115.
19. Ernst, O; O Bentancur & R Borges. 2002. Descomposición de rastrojo de los cultivos en siembra directa sin laboreo: Trigo, Maíz,
Soja y Trigo después de Maíz o de Soja. Agrociencia 6(1): 20-26.
20. Fabrizzi, K; L Picone; A Berardo & F García. 1998. Efecto de la fertilización nitrogenada y fosforada en las propiedades químicas de un
suelo Argiudol típico. Ci. Suelo 16: 71-76.
21. Fabrizzi, KP; A Morón & F García. 2003. Soil C and N organic fractions
in degraded vs. non-degraded Mollisols in Argentina. Soil Sci. Soc.
Am. J. 67: 1831-1841.
22. Fierer N; KM Carney; MC Horner-Devine & JP Megonigal. 2009. The
biogeography of ammonia-oxidizing bacterial communities in soil. Microbiol. Ecol. 58: 435-445.
23. Frioni, L. 2006. Microbiología: Básica, ambiental y agrícola. Publicaciones Facultad de Agronomía, Universidad de la República
Oriental del Uruguay, Montevideo, Uruguay. 464 pp.
24. Galantini, JA; J Iglesias; M Landriscini; L Suñer & G Minoldo. 2008.
Calidad y dinámica de las fracciones orgánicas en sistemas naturales y cultivados. En: Galantini, JA (ed). Estudio de las fracciones
orgánicas en suelos de la Argentina. 1ra. Ed. Editorial UNS. Bahía
Blanca, Bs. As., Argentina. Pp. 71-95.
25. Gasparoni, JC. 2008. Determinación de la materia orgánica del suelo. En: Galantini, JA (ed). Estudio de las fracciones orgánicas en suelos
de la Argentina. 1ra edn. Editorial UNS. Bahía Blanca, Bs. As., Argentina. Pp. 41-50.
26. GelCompare II. 2005. Version 4.602 of Applied Maths NV
27. Gianello, C & JM Bremner. 1986. A simple chemical method of
assessing potentially available organic nitrogen in soil. Community Soil Sci. Plant. Anal. 17: 195-214.
28. Glaser, K; E Hackl; E Inselsbacher; J Strauss; W Wanek; S Zechmeister-Boltenstern & A Sessitsch. 2010. Dynamics of ammonia-oxidizing
communities in barley-planted bulk soil and rhizosphere following
nitrate and ammonium fertilizer amendment. FEMS Microbiol. Ecol.
74: 575-591.
29. González, M; L Marbán & M Conti. 2011. Reacción del suelo. En: Conti,
M & L Giuffré L. (eds). Edafología, bases y aplicaciones ambientales
Argentinas. 1ra. edn. Editorial Facultad de Agronomía. Buenos Aires,
Argentina. Pp. 297-312.
30. Gregorutti, CV; LE Novelli; RJM Melchiori; MV Ormaechea & OP Caviglia.
2014. Nitrógeno incubado en anaerobiosis y su relación con el
nitrógeno orgánico en diferentes fracciones. Ci. Suelo 32(1): 41-51.
31. He, J.; J Shen; L Zhang; Y Zhu; Y Zheng; M Xu & HJ Di. 2007. Quantitative
analyses of the abundance and composition of ammonia-oxidizing
bacteria and ammonia-oxidizing archaea of a Chinese upland red
soil under long-term fertilization practices. Environ. Microbiol. 9(9):
2364-2374.
32. Hiorns, WD; RC Hastings; IM Head; AJ McCarthy; JR Saunders; RW
Pickup & GH Hall. 1995. Amplification of 16s ribosomal RNA genes
of autotrophic ammonia-oxidizing bacteria demonstrates the
ubiquity of nitrosospiras in the environment. Microbiol. 141: 2793-2800.
33. INTA, 1978. Carta de Suelos de la República Argentina. Hoja 3363-17. Marcos Juárez. Instituto Nacional de Tecnología Agropecuaria,
Buenos Aires, Argentina. 86 pp.
34. IRAM (Instituto de Normalización), 1999. Norma 29410. Determinación del pH.
35. Keeney, DR. 1982. Nitrogen Availability Indices. In: Page, AL et al., (eds). Methods of Soil Analysis. Part 2. Chemical and Microbiological
Properties. Soil Sci. Soc. of Am. Madison, Wisconsin, USA. Pp. 711-733.
36. Kimura, M. 1980. A simple method for estimating evolutionary rate
of base substitutions through comparative studies of nucleotide
sequences. J. Molecular Evol. 16: 111-120.
37. Kowalchuk, GA & JR Stephen. 2001. Ammonia-Oxidizing Bacteria:
A Model for Molecular Microbial Ecology. Ann. Rev. Microbiol. 55:
485-429.
38. Kowalchuk, GA; JR Stephen; W De Boer; JI Prosser; TM Embley & JW
Woldendorp. 1997. Analysis of ammonia-oxidizing bacteria of the
Beta subdivision of the class Proteobacteria in coastal sand dunes
by denaturing gradient gel electrophoresis and sequencing of PCR-amplified 16S ribosomal DNA fragments. Appl. Environ. Microbiol.
63: 1489-1497.
39. Lavado, RS. 2010. La fertilidad, sus características y la utilización de
fertilizantes. En: Álvarez, R; G Rubio; CR Álvarez & RS Lavado (eds).
Fertilidad de Suelos. Caracterización y Manejo en la Región
Pampeana. Ed. Facultad de Agronomía, UBA, Argentina. Pp.1-8.
40. Miller Blanco Gallego, J. 2012. Efecto de dos abonos verdes sobre la
mineralización del nitrógeno y la dinámica de bacterias oxidantes
del amoniaco y del nitrito en un ciclo de cultivo de maíz Zea mays
L. Tesis de Maestría. UNC Palmira, Colombia. 145 pp.
41. Muyzer, G; EC de Waal & AG Uitterlinden. 1993. Profiling of complex
microbial populations by denaturing gradient gel electrophoresis
analysis of polymerase chain reaction-amplified genes coding for
16S rRNA. Appl. Environ. Microbiol. 59: 695-700.
42. Nicol, GW; S Leininger; C Schleper & JI Prosser. 2008. The influence
of soil pH on the diversity, abundance and transcriptional activity
of ammonia oxidizing archaea and bacteria. Environ. Microbiol.
10: 2966-2978.
43. Nicolaisen, MH & NB Ramsing. 2002. Denaturing gradient gel
electrophoresis (DGGE) approaches to study the diversity of
ammonia-oxidizing bacteria. J. Microbiol. Methods 50: 189-203.
44. Nieder, R; DK Bendi & HW Scherer. 2010. Fixation and defixation
of ammonium in soils: A Review. Biol. Fertil. Soils DOI 10.1007/s00374-010-0506-4.
45. Orozco, F. 1999. La Biología del Nitrógeno, conceptos básicos sobre
sus transformaciones biológicas. Tomo I. Publicaciones Universidad Nacional de Colombia. Medellin, Colombia. 231 pp.
46. Pommerening-Röser, A. & HP Koops. 2005. Environmental pH as an
important factor for the distribution of urease positive ammonia-oxidizing bacteria. Microbiol. Res. 160: 27-35.
47. Shen, J; L Zhang; Y Zhu; J Zhang & J He. 2008. Abundance and
composition of ammonia-oxidizing bacteria and ammonia-oxidizing archaea communities of an alkaline sandy loam. Environ.
Microbiol. 10(6): 1601-1611.
48. Sow, SL; G Khoo; LK Chong; TJ Smith; PL Harrison & HK Ong. 2014.
Molecular diversity of ammonia-oxidizing bacteria community
in disused tin-mining ponds located within Kampar, Perak, Malaysia. World J. Microbiol. Biotechnol. 30: 757-766.
49. Tamura, K; G Stecher; D Peterson; A Filipski & S Kumar. 2013. MEGA
6: Molecular Evolutionary Genetics Analysis Version 6.0. Molecular
Biol. & Evol. 30: 2725-2729.
50. Taylor, AE; LH Zeglin; TA Wanzek; DD Myrold & PJ Bottomley. 2012.
Dynamics of ammonia-oxidizing archaea and bacteria populations
and contributions to soil nitrification potentials. The ISME J. 6:
2024-2032.
51. Ward, BB. 2008. Nitrification. In: Jorgensen, SE & BD Fath (eds).
Ecological Processes. Vol (3) Encyclopedia of Ecology. Princeton,
NJ, USA. Pp. 2511-2518.
52. Walkley, A & IA Black. 1934. An examination of Degtjareff method
for determining soil organic matter, and a proposed modification
of the chromic acid titration method. Soil Sci. 37: 29-38.
53. Wright, AL; FM Hons & JE Matocha. 2005. Tillage impacts on microbial
biomass and soil carbon and nitrogen dynamics of corn and cotton
rotations. Appl. Soil Ecol. 29: 85-92.
54. Wyngaard, N; HE Echeverría; HR Sainz Rozas & GA Divito. 2012.
Fertilization and tillage effects on soil properties and maize yield in
a Southern Pampas Argiudoll. Soil & Till. Res. 119: 22-30.
55. Yu, W; Y Xu; M Bi; Q Ma & H Zhou. 2010. Activity and Composition
of Ammonia-Oxiding Bacteria in an Aquic Brown Soil as Influenced
by Land Use and Fertilization. Pedosphere 20(6): 798-798.
56. Zhang, B; B Sun; M Ji; H Liu & X Liu. 2010a. Quantification and
comparison ofammonia-oxidizing bacterial communities in MBRs
treating various types of wastewater. Bioresource Technol. 101:
3054-3059.





