![]()
TRABAJOS
Stocks y relaciones de estratificación del carbono y nitrógeno en oxisoles bajo sistemas forestales
Silvia Amanda Arzuaga1*; Diana Marcela Toledo1; Stella Maris Contreras Leiva1 & Sara Vázquez1
1 Cátedra de Edafología, Facultad de Ciencias Agrarias - UNNE. Sargento Cabral 2131, Corrientes 3.400. Argentina
* Autor de contacto: arzuaga@agr.unne.edu.ar
Recibido: 30-12-15
Recibido con revisiones: 02-07-15
Aceptado: 16-10-15
RESUMEN
El objetivo de este trabajo fue evaluar los efectos del desmonte y posterior reforestación con coníferas (Pinus sp.) sobre las reservas de carbono y nitrógeno del suelo, y sus relaciones de estratificación en Oxisoles. En el departamento de Oberá (Misiones), con un diseño completamente al azar, se seleccionaron doce reservas de Selva subtropical (S) y doce lotes con forestaciones de Pinus sp. de 20 años de edad (P). En cada uno se realizó un muestreo de suelo, compuesto, aleatorio simple, a 3 profundidades: 0-0,10; 0,10-0,20; 0,20-0,30 m. Las variables evaluadas fueron: textura, pH, densidad aparente (Da), carbono orgánico (COS) y nitrógeno total (N). Se calcularon los stocks de carbono (SC) y de nitrógeno (SN) de 0 a 0,30 m, la tasa de acumulación de carbono (TACOS) y las relaciones de estratificación del COS y del N (COSr y Nr). Los suelos bajo P presentaron menores valores de COS, N, SC y SN, en tanto que la TACOS fue -0,86 Mg C ha-1 año-1, señalando degradación del suelo. Las COSr fueron mayores en S, tomando valores superiores a 2, denotando una alta calidad de suelo. La eliminación de la S y su reemplazo por P provocó una pérdida del 28% del SC y del 51% del SN, indicando degradación y pérdida de calidad del suelo por el uso forestal.
Palabras clave: Uso forestal; Contenidos orgánicos; Tasas de estratificación y acumulación; Oxisoles.
Carbon and nitrogen stocks and stratification ratios in oxisols under forest systems
ABSTRACT
The objective of this study was to assess the effect of deforestation and subsequent conifer reforestation on carbon stocks (CS) and nitrogen stock (NS), and their stratification ratios in Oxisols. A completely randomized design was used, with twelve plots under subtropical rainforest (S) and twelve plots under plantation of 20-year-old pines (P) at the Department of Oberá (Misiones). For each plot, composite samples were collected at 0-0.10; 0.10-0.20 and 0.20-0.30 m depths. The following variables were measured: texture, pH, bulk density (Bd), soil organic carbon (SOC) and total nitrogen (Nt). Carbon and nitrogen stocks as well as the carbon accumulation rate (TACOS) were calculated from 0 to 0.30 m. Then, the carbon stratification ratios (SOCr) and the nitrogen stratification ratios (Nr) were determined. Lower values for SOC and Nt content, as well as their respective stock decline, were indicative of soil degradation in the pine plantation. The COSr were higher in the subtropical rainforest (>2) which indicated enhanced soil quality. The carbon accumulation rate in the forest soil was - 0.86 Mg C ha-1 year-1, which revealed soil carbon loss. Removal of the subtropical rainforest and subsequent conifer reforestation reduced SC and SN by 28% and 51%, respectively. Forest land-use, hence, resulted in soil degradation and poorer soil quality.
Key words: Forest land-use; Carbon and nitrogen content; Stratification rate; Carbon accumulation rate; Oxisols.
INTRODUCCIÓN
La capacidad de los suelos para acumular y estabilizar
carbono orgánico (COS) ha recibido una gran atención en los últimos años, siendo los suelos de los ecosistemas forestales
un reservorio importante del CO2 atmosférico, proveyendo
un servicio ambiental como sumideros de carbono (De Wit et al., 2006; Torres Rojo & Guevara Sangines, 2002).
El contenido de materia orgánica es generalmente considerado como uno de los indicadores primarios de la calidad
del suelo, tanto en sus funciones agrícolas como ambientales.
La calidad de suelo puede definirse como la capacidad del
suelo para funcionar dentro de los límites de un ecosistema
natural o manejado, sustentar la productividad de plantas
y animales, mantener o mejorar la calidad del aire y del agua,
y sostener la salud humana y el hábitat (Doran & Parkin,
1994).
Es necesario evaluar y monitorear dicha calidad con el
objetivo de mejorar o conservar la fertilidad y la productividad del suelo, garantizando la sustentabilidad de los agroecosistemas. Por lo tanto, como parte de las estrategias para
lograrlo, resulta indispensable la selección y uso de indicadores de calidad que proporcionen información sobre los
cambios generados en las propiedades edáficas como consecuencia del uso y del manejo. (Karlen et al., 2001; Astier et al., 2002).
El COS es el indicador de calidad de suelo más utilizado
en los suelos forestales (Zornoza et al., 2015). Aproximadamente el 50% del total de carbono (C) contenido en los
ecosistemas terrestres, se encuentra en los suelos y en la
biomasa de los ecosistemas forestales, dentro de los cuales
los que acumulan las mayores cantidades de C son los bosques tropicales y los boreales, sin embargo, en estos sistemas
la distribución interna del mismo es muy diferente (García
Oliva et al., 2006).
En la provincia de Misiones, la disminución de la superficie bajo selva prístina, obedece principalmente al cambio del
uso del suelo con fines agrícola y forestal, en particular con
destino a bosques implantados con especies exóticas de rápido crecimiento. La tasa de deforestación anual es alrededor
de 1,3%, resultando en una superficie deforestada de aproximadamente 60.000 ha año-1, según datos de la Unidad de
Manejo del Sistema de Evaluación Forestal (Del Valle et al.,
2011). En base al Sistema de Información Foresto Industrial
de la Provincia, la misma cuenta con 365 mil hectáreas de
bosques implantados, siendo una de las zonas forestales más importantes del país, de los cuales 83% corresponde a Pinus sp., 7% a Eucalyptus sp., 4,5% a Araucaria sp., y el restante
a otras especies (Uasuf & Hilbert, 2012). Autores tales como
Giuffré et al. (2002) y Lupi et al. (2012), señalaron que en
la provincia de Misiones, la implementación de técnicas intensivas forestales (quema más laboreo), produce una reducción en los niveles de MO total, de su fracción liviana,
como así también de algunos nutrientes como el nitrógeno.
Zinn et al. (2002) encontraron pérdidas de COS de 11
Mg ha-1 en Oxisoles de Cerrados de Brasil, cuando la vegetación natural fue reemplazada por forestaciones de pinos.
Los cambios en las reservas de carbono debidas al uso de las
tierras, han sido en general establecidos a partir de comparaciones de los stocks de carbono en suelos bajo diferentes
sistemas (Toledo et al., 2013a). Esta comparación puede
producir errores considerables, cuando las mismas se efectúan considerando masas de suelo diferentes por cuanto los
métodos usados a menudo no son lo suficientemente precisos para cuantificar y verificar el secuestro de carbono (Ellertet al., 2001).
Veldkamp (1994), sugirió que al comparar el contenido
total de COS en forestales, con los de cultivo o pastoreo, si
el muestreo está basado en la profundidad, la misma deberá ser ajustada para evitar un error debido a diferencias en la
densidad aparente. Toledo et al. (2013a) efectuaron comparaciones de distintos métodos de cálculo de stock de COS
y propusieron para suelos rojos de Misiones, efectuar correcciones de masa, empleando el método de Solomon et al. (2002), en base a una profundidad equivalente o el
método gráfico de McBratney & Minasny (2010).
Franzluebbers et al. (2002) propusieron para la evaluación del efecto del uso de las tierras, la distribución del COS
con la profundidad (estratificación) y sus relaciones, como
indicadores de calidad, y empleadas por numerosos autores
en el estudio de sistemas naturales, pastizales, bosques cultivados, y sistemas agrícolas (Blanco-Canqui et al., 2008; Jinboet al., 2007; Franzluebbers, 2008). Franzluebbers (2010),
observó una mayor estratificación del COS con la profundidad en Ultisoles bajo forestaciones y pasturas, respecto a suelos
agrícolas con labranza convencional; destacando un impacto
positivo sobre propiedades del suelo como estabilidad estructural, infiltración, ciclado de nutrientes, y secuestro de carbono. Moraes Sá & Lal (2009) observaron, en Oxisoles de Brasil,
que el COS y el N disminuyeron con la profundidad y una
tendencia opuesta observaron con las relaciones de estratificación. Señalaron también una correlación lineal positiva entre el secuestro de COS y las relaciones de estratificación de COS. Asimismo, Toledo et al. (2013b), determinaron que las relaciones de estratificación del COS y del
nitrógeno potenciamente mineralizable (NPM) son buenos
indicadores de calidad en Oxisoles bajo uso agrícola (cultivo
anual de maíz y perenne de té).
El nitrógeno presente en el suelo, se encuentra estrechamente vinculado a la captación y almacenamiento del
COS, por tal motivo es también importante conocer como
las reservas de N y los flujos se ven afectados por el cambio
de uso del suelo (Zhao et al., 2014).
Autores como Dalurzo et al. (2005), Piccolo et al.
(2008), Toledo et al. (2010) en Oxisoles y Ultisoles de
Misiones bajo selva subtropical encontraron contenidos
de COS entre 53 y 40 g kg-1 en los primeros 0,10 m del perfil.
Dalurzo (2002) señaló valores de N de 4,8 g kg-1 para
suelos prístinos, en tanto que Martiarena et al. (2013)
encontraron en suelos rojos de Misiones bajo plantaciones de Pinus taeda L. valores de N de 1,5 y 1,18 g kg-1.
Si bien se puede encontrar numerosa bibliografía respecto al impacto del uso del suelo sobre los stocks de COS
y N, la mayoría hace referencia a agroecosistemas, siendo
pocos los estudios que han evaluado la capacidad de sumidero de C de suelos forestales (Lal, 2001; Lal, 2004).
El objetivo de este trabajo fue evaluar los efectos del
desmonte y posterior forestación con coníferas (Pinus sp.)
sobre las reservas de carbono y nitrógeno, y sus relaciones
de estratificación en Oxisoles.
MATERIALES Y MÉTODOS
El trabajo fue llevado a cabo en Eutrudoxes ródicos del
departamento de Oberá (27º41’S, 55º11’W), provincia de Misiones. El clima de la región corresponde en el Sistema de clasificación climática de Köpen-Geiger a Cfa, clima subtropical húmedo, con precipitaciones de 1700 a 2000 mm anuales, y temperatura media anual de 19,5 °C (Kottek et al., 2006). Se empleó un diseño completamente al azar, con dos tratamientos:
Selva subtropical (S) y forestación con Pinus sp. (P). Se muestrearon suelos de 12 lotes implantados con Pinus sp. y 12 reservas de selva sin disturbio antrópico próximas a los lotes forestados.
El tratamiento S correspondió a una selva subtropical heterogénea, con una alta biodiversidad, presentando formaciones
multiestratificadas de 20 a 30 m de altura, con tres estratos:
bambúceas y arbustos, herbáceo y un estrato muscinal; también abundantes lianas y epífitas (Gasparri et al., 2004). El tratamiento P, correspondió a lotes desmontados y forestados con Pinus sp. (P) de 20 años de edad, con manejo convencional de
la zona, con una densidad promedio de 1100 árboles ha-1. En cada tratamiento se extrajeron de cada uno de los 12 lotes tres
muestras compuestas (de tres submuestras) de suelo tomadas
a 3 profundidades: 0-0,10; 0,10-0,20; 0,20-0,30 m.
Las muestras de suelo extraídas fueron secadas al aire,
molidas con mortero manual, tamizadas por malla de 2 mm,
y secadas en estufa a 105 ºC por 24 horas para determinar el
contenido de agua gravimétricamente. Los resultados se expresaron en base a suelo seco a 105 ºC.
Para determinar densidad aparente, en cada tratamiento
se extrajeron 3 muestras simples, para cada una de las profundidades consideradas, manteniendo intacta la estructura del
suelo utilizando cilindros de Kopecki.
Las variables evaluadas fueron: textura por el método de
Bouyoucos (Dewis & Freitas, 1970), pH, método potenciométrico
con una relación 1:2,5 en KCl 0,1 M (Dewis & Freitas, 1970);
densidad aparente (Da) método del cilindro (Forsythe, 1975);
carbono orgánico (COS) método de Walkley & Black modificado (Nelson & Sommmers, 1996) y nitrógeno total (N) por
Bremmer & Mulvaney (1982).
Se calcularon los stocks de COS y N (SC y SN respectivamente) hasta una profundidad de 0,30 m conforme a lo propuesto por el IPCC (2000), la tasa de acumulación de carbono
(TACOS) y las relaciones de estratificación del COS y del N (COSr y Nr).
Stocks de COS y N: (SC y SN)
En suelos sin disturbar se aplicó la ecuación propuesta por
Ussiri et al. (2006):
donde:
X: Stock de COS ó N en Mg ha-1
x: es el contenido de COS o N en % según datos determinados
Da: densidad aparente (Mg m-3)
e: espesor considerado (m)
En los suelos disturbados (forestados) los stocks fueron calculados aplicando la metodología propuesta por Solomon et al., (2002) a fin de realizar comparaciones entre masas equivalentes de suelo, efectuando las correcciones por profundidad equivalente. Los Stocks X (COS ó N, Mg ha-1) fueron calculados a partir de los contenidos de COS ó N de las muestras (x, g kg-1 de suelo), el espesor considerado Z (m) y la densidad aparente Da (Mg m-3) mediante la siguiente ecuación:
Stock X Mgha-1 = xZc * Da * 10
El reemplazo de la selva y el cultivo del suelo usualmente causa compactación en consecuencia la densidad aparente en el suelo cultivado aumenta con el tiempo. Esto hace que no sean directamente comparables las situaciones para una misma profundidad, por cuanto es necesario recurrir a correcciones. En este trabajo, el espesor de los suelos cultivados (Z) fue corregido (Zc) de la siguiente manera, asumiendo que la densidad aparente y la profundidad de los suelos cultivados fueron originalmente los mismos a aquellos que correspondieron a los suelos prístinos (Solomon et al., 2002):
En los suelos bajo estudio las formas de carbono inorgánico no se encuentran presentes por cuanto: Carbono orgánico (COS) = Carbono total (CT) (Schumacher, 2002).
Tasa de acumulación de carbono edáfico (TACOS): fue obtenida mediante las diferencias de Stock de COS entre la situación prístina y la situación actual, y los años de uso forestal aplicando la ecuación adaptada de Amado et al. (2006):
Relaciones de estratificación del COS y N: se establecieron las relaciones COSr1 y Nr1, a partir de los contenidos de COS
y N determinados a 0–0,10 m y 0,20-0,30 m (Franzluebbers,
2002) y COSr2 y Nr2 considerando COS y N de a 0–0,10 m y 0,10-
0,20 m de profundidad (Costantini et al., 2010 y Toledo et al.,
2013a).
Análisis estadístico: los resultados obtenidos fueron analizados mediante ANOVA, efectuándose comparaciones de
medias utilizando el Test LSD (p<0,05). Se realizó una correlación de Pearson entre los stocks y las relaciones de estratificación. Los datos fueron procesados empleando el software
estadístico Infostat (Di Rienzo et al., 2011).
RESULTADOS Y DISCUSIÓN
Los suelos bajo estudio resultaron ácidos y arcillosos,
los valores medios de los atributos estudiados se presentan en la Tabla 1.
Tabla 1. Valores medios de pH, densidad aparente (Da), carbono orgánico del suelo (COS), nitrógeno total
(N), en suelos bajo selva (S) y pino (P).
Table 1. Mean contents of pH, bulk density (Da), organic carbon (COS) total nitrogen (N) of soils under
subtropical rainforest (S) and pine (P).
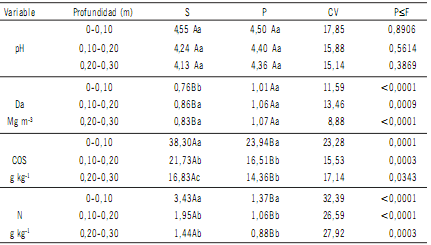
Letras distintas en las columnas indican diferencias estadísticas significativas entre tratamientos (p<0,05).
Letras distintas entre filas indican diferencias estadísticas significativas entre profundidades (p<0,05).
Different letters in columns indicate statistically significant differences between treatments (p<0.05).
Different letters between rows indicate statistically significant differences between depths (p<0.05).
Los mayores valores de Da se observaron bajo P con diferencias significativas (p<0,0001) respecto del tratamiento S (Tabla 1). Este atributo en la situación prístina, fue similar a lo observado por Carvalho (2010) en Oxisoles quien encontró una Da de 0,82 Mg m-3, para los primeros 0,05 m bajo vegetación nativa, al norte del estado de Mato Grosso (Brasil).
Carbono orgánico (COS) y Nitrógeno total (N)
El desmonte y cambio de uso, provocó una disminución de los contenidos orgánicos del suelo, el tratamiento
P produjo en los primeros 0,10 m de suelo una disminución de las reservas de COS y de N del 37,5% y del 60%,
respectivamente. Las pérdidas de COS y N para las dos profundidades siguientes fueron del 24 y 15% para el COS
y del 45 y 39% para el N. Como era de esperar, las pérdidas
de COS por efecto del uso produjeron a su vez disminuciones en el N debido a la estrecha relación entre la materia
orgánica del suelo y los depósitos y flujos de nitrógeno
edáfico (Zhao et al., 2014). Similares pérdidas de nitrógeno total fueron encontradas en suelos rojos por Dalurzo
(2002) en Eutrodoxes ródicos desmontados y posteriormente cultivados con yerba mate, y por Dalurzo et al. (2005)
y Toledo et al. (2010) bajo cultivo de citrus y de tabaco
respectivamente. Fernández (1987), halló una disminución significativa en la materia orgánica y el nitrógeno en
muestras de 0-0,10 m y de 0,30-0,40 m de profundidad
en Ultisoles de Misiones como consecuencia del desmonte del bosque nativo y su reemplazo con Pinus sp. En regiones subtropicales, los suelos bajo selva reciben un
constante aporte de materia orgánica no sólo desde la hojarasca sino también por la gran abundancia de raíces y
raicillas que se renuevan constantemente (Dalurzo et al.,
2005). Moraes Sá & Lal (2009), en Oxisoles del Estado de
Paraná (Brasil), hallaron en suelos bajo vegetación natural
valores de COS de 41g kg-1 y 35 g kg-1 para los 0 a 0,05 m
y 0,05 a 0,10 m, respectivamente.
Esta disminución de las reservas provocada por la introducción de especies arbóreas de rápido crecimiento,
coincide con lo señalado por Turner & Lambert, (2000),
Bouillet & Bernhard-Reversat (2001) y Brand et al. (2000)
y fue principalmente atribuida al manejo de tala y preparación del suelo. Monreal et al. (2005), encontraron que
en los sistemas forestados, el COS acumulado en los primeros 0,15 m fue cerca del doble del correspondiente a la
profundidad de 0,15 a 0,30 m. Guo & Gifford (2002) observaron que en plantaciones de coníferas sobre antecesor selva, la cantidad de COS se redujo en un 20% en edades
de plantación menores a los 40 años, y que a partir de allí el COS aumentaba sustancialmente y en algunos casos
llegaba a valores similares a la selva.
Reservas de carbono (SC) y de Nitrógeno total (SN)
El SC en la S, en suelo sin disturbar fue de 62 Mg C ha-1
para los primeros 0,30 m de profundidad, observando que
en los suelos bajo P se determinaron pérdidas del orden
28% (Tabla 2). Toledo et al., 2013a en Oxisoles de Misiones, utilizando el mismo método de cálculo para SC (Solomon et al., 2002), obtuvieron para cultivos perennes
(mandarina Satsuma) un valor medio de SC de 42,10 Mg
C ha-1 y para cultivos anuales (tabaco) 40,73 Mg C ha-1,
determinando pérdidas debidas al cambio en el uso de las
tierras del orden del 32% y 34%, respectivamente. En tanto
que en Ultisoles de Misiones bajo Pinus taeda L., Pinazo
et al. (2007) señalaron un SC de 59 Mg C ha-1 para los
primeros 0,30 m. En cuanto al SN, en suelos bajo P fue de
2,69 Mg N ha-1, por cuanto la forestación produjo una caída
del orden del 51% en los primeros 0,30 m. Toledo et al.,
(2010) hallaron similares pérdidas de SN cuando la selva
Misionera fue reemplazada por cultivos anuales de escarda continuos por más de 15 años (54%). Moraes Sá & Lal
(2009) hallaron en Oxisoles con vegetación nativa de
Campos Gerais do Paraná, Brasil 7,44 Mg N ha-1.
Tabla 2. Stock de carbono orgánico (SCOS) y nitrógeno total del suelo
(SN) de 0-0,30 m de profundidad en selva subtropical y Pinus sp.
en Misiones.
Table 2. Stock of soil organic carbon (SC) and total nitrogen (SN) of
0-0,30 m deep in subtropical rainforest and Pinus sp. Misiones.

Letras distintas en la misma columna indican diferencias estadísticas
significativas (p<0,05).
Different letters in the same column indicate statistically significant
differences (p <0,05).
Entre el SC y el SN hubo una alta correlación (r=0,74)
positiva y significativa (p<0,05).
Las pérdidas del SN fueron superiores a las pérdidas de
SC en un 23%, lo cual fue atribuido a que en estos sistemas forestales si bien se conservan los residuos de cosecha, no
se realizan reposiciones de nitrógeno mediante fertilizaciones, por lo cual el crecimiento de las plantaciones se debe
a las condiciones propias del sitio.
Relaciones de estratificación del COS (COSr)
y del N (Nr)
Las relaciones de estratificación del COS y del N (COSr1,
COSr2, Nr1, y Nr2) permitieron observar que existe mayor
estratificación en suelos prístinos.
La COSr1 resultó superior a 2 (Fig. 1), en coincidencia
con lo hallado por Franzluebbers (2002) quien destacó que
suelos clímax presentarían COSr1 >2 y que valores menores indicarían degradación del suelo.

Figura 1. Relaciones de estratificación del COS y N bajo selva subtropical y Pinus sp. en Oxisoles de Misiones, entre 0-0,10 m/0,20-0,30 m (COSr1 y Nr1) y 0-0,10 m/0,10-0,20 m (COSr2 y Nr2). Letras distintas significan diferencias estadísticas significativas entre tratamientos (p<0,05).
Figure 1. Stratification ratios of COS y N under subtropical rainforest and Pinus sp. in Misiones Oxisols, between 0-0,10 m/0,20-0,30 m (COSr1
and
Nr1) and 0.0,10 m/0,10-0,20 m (COSr2
and Nr2). Different letters represent significant differences statistical among treatments (p<0,05).
En la S se presentaron los mayores valores de Nr1, siendo estos cercanos a 2,5 mientras que los suelos forestados
mostraron una relación Nr1>1,5. Las relaciones COSr2 y Nr2 permitieron distinguir suelos nativos de los forestados P,
siendo el valor de COSr2 para suelos prístinos >1,5 y para
forestados <1,5 en coincidencia con lo indicado por Toledo et al. (2013b) para suelos clímax y suelos agrícolas respectivamente. Moraes Sá & Lal (2009) usando las relaciones de
estratificación del COS y N como indicadores de secuestro
de carbono en Oxisoles de Brasil, compararon suelos naturales y agrícolas indicando disminuciones en suelos disturbados, atribuyendo esto a la ruptura de los agregados.
El SC correlacionó positiva y significativamente con el stock
de N (r=0,74), y con las relaciones de estratificación COSr1 (r=0,60) y COSr2 (r=0,59); p<0,05. En tanto que el SN
correlacionó positiva y significativamente con las relaciones
de estratificación; COSr1 (r=0,60), COSr2 (r=0,56), Nr1 (r=0,42) y Nr2 (r=0,61); (p<0,05). Similares correlaciones
fueron obtenidas por Moraes Sá & Lal (2009), y Costantiniet al. (2010) en suelos bajo uso agrícola.
Tasa de acumulación de carbono (TACOS)
La TACOS de 0 a 0,30 m de profundidad bajo P fue -
0,86 Mg C ha-1 año-1, por lo que no hubo acumulación, sino pérdidas de C en estos lotes con 20 años bajo P. Diferente
de lo encontrado por Richster et al. (1999) citado por
Franzluebbers (2010) en suelos bajo plantaciones de pino
en Carolina del Sur (USA), el secuestro de carbono fue de
0,95 Mg C ha-1 año-1, en la capa hojarasca-suelo 0,04 Mg
C ha-1 año-1 de 0 a 15 cm de profundidad y sin cambio o
tendiendo a disminuir de 15 a 60 cm. Amado et al. (2006)
en Hapludoxes bajo cultivo de poroto negro-maíz determinaron también pérdidas similares. En regiones subtropicales,
Toledo et al. (2010) encontraron una TACOS en cultivos
de maíz de -1,3 Mg C ha-1 año-1 en tanto que Amado et al.
(2006), encontraron 0,16 Mg C ha-1 año-1.
CONCLUSIONES
La eliminación de la selva subtropical y su reemplazo
con forestaciones de Pinus sp, por un período de 20 años,
produce pérdidas de las reservas de carbono y nitrógeno
(28 y 51%, respectivamente) y disminuciones de las relaciones de estratificación indicando una degradación y
pérdida de calidad del suelo por el uso forestal.
AGRADECIMIENTOS
A la Secretaría General de Ciencia y Técnica de la Universidad Nacional del Nordeste por el financiamiento de la presente investigación. A la traductora P. Motter por su cooperación en la revisión del resumen en inglés del presente trabajo.
BIBLIOGRAFÍA
1. Amado, TJC; C Bayer; PC Conceiçao; E Spagnollo; B Costa de Campos & M da Veiga. 2006. Potential of carbon accumulation in no-till soils with intensive use and cover crops in southern Brazil. J. Environ. Qual. 35: 1599-1607.
2. Astier-Calderón, M; M Maass-Moreno & J Etchevers-Barra. 2002. Derivación de indicadores de calidad de suelos en el contexto de la agricultura sustentable. Agrociencia 36(5): 605-620.
3. Blanco-Canqui, H.& R Lal. 2008. No-tillage and soil-profile carbon sequestration: an on-farm assessment. Soil Sci. Soc. Am. J. 72, 693-701.
4. Bouillet, JP & B Bernhard-Reversat. 2001. General objectives and sites. In: Bernhard-Reversat, F. (ed) 2001. Effect of exotic tree plantations on plant diversity and biological soil fertility in the Congo savanna: with special reference to eucalypts. Center for International Forestry Research, Bogor, Indonesia, 71p. pp: 6-12.
5. Brand, DG; A Cowie & K Lamb. 2000. Developing the products and markets for carbon sequestration in planted forests. In: The Future of Eucalypts for Wood Products, Launceston, Tasmania, Australia, 52-63 pp.
6. Bremmer, AE & CS Mulvaney. 1982. Total nitrogen. In: Page et al. (eds). Methods of 426 soil analysis, Part 2, Pp. 595-624. Am. Soc. Agron. and Soil Sci. Soc. Am. J., Madison.
7. Carvalho, JLN. 2010. Dinamica do carbono e fluxo de gases do efeito estufa em sistemas de integracao lavoura-pecuaria na Amazonia e no Cerrado. Piracicaba, 1141p. Tesis (Doutorado)- Escola Superior de Agricultura -Luiz de Queiroz.
8. Costantini, A; C Alvarez; CR Álvarez; E Martellotto & E Lovera. 2010. Uso de la relación de estratificación del carbono orgánico como indicador de efectos del manejo sobre el suelo y el secuestro de carbono. XXII Congreso Argentino de la Ciencia del Suelo. 31de mayo al 4 de junio de 2010. Rosario, Argentina. AACS.
9. Dalurzo, HC. 2002. Agregado de residuos orgánicos en suelos ferralíticos. Efecto sobre variables que estiman sustentabilidad. Tesis de Magíster Scientiae. Área: Ciencia del Suelo. Escuela para Graduados Alberto Soriano UBA.
10. Dalurzo, HC; DM Toledo & S Vazquez. 2005. Parámetros químicos y biológicos en Oxisoles con uso citrícola. Ciencia del Suelo (Argentina) 23: 159-165.
11. Del Valle, P; M Grulke; B Lorente & LN López. 2011. Proyecto Manejo Sostenible de los Recursos Naturales - Componente Bosques Nativos y su Biodiversidad. Informe técnico. Modelos de Producción Sostenible para la Ecorregión Selva Misionera. Informe técnico en el marco de la consultoría: Manual de Buenas Prácticas y Modelos de Producción Sostenible. 2011. UNIQUE. El Dorado y Freiburg, noviembre de 2011.
12. Dewis, J & F Freitas. 1970. Métodos físicos y químicos de análisis de suelos y aguas. Boletín sobre suelos Nº 10. FAO. 438 Roma. Pp. 36-57.
13. De Wit, HA; T Palosuo; G Hylen & J Liski. 2006. A carbon budget of forest in southeast Norway. Forest Ecol Manag., 225: 15-26.
14. Di Rienzo, JA; F Casanoves; MG Balzarini; L Gonzalez; M Tablada & CW Robledo. 2011. InfoStat, Versión 2011. Grupo InfoStat. FCA, UNC, Córdoba, Argentina.
15. Doran, JW & TB Parkin. 1994. Defining and assessing soil quality p. 3-21. In: JW Doran et al. (ed.) Defining soil quality for a sustainable environment. SSSA Special Publ. 35. SSSA and ASA. Madison, WI.
16. Ellert, BH; HH Janzen & BG McConkey. 2001. Measuring and Comparing Soil Carbon Storage. Chapter 10, In: Assessmente Methods for Soil Carbon. Edited by: R. Lal, JM Kimble, RF Follett and BA Stewart. Lewis Publishers, Boca Raton.
17. Fernández, RA. 1987. Influencia del sistema desmonte-reforestación con Pinus spp sobre algunas características químicas de los suelos. Ciencia del Suelo 5(2): 123-129.
18. Fernández, R; P Mac Donagh; A Lupi; E Crechi; J Bernio; R Martiarena & M Marek. 2000. Compactación del Suelo y su Relación con el Crecimiento de la Segunda Rotación del Pinus Taeda en Misiones, argentina. INTA Monte Carlo, Misiones. http://www.elsitioagricola./articulos/fernandezr/Compactacion. 11/11/2013.
19. Forsythe, W. 1975. Física de Suelos. IICA. 212 p. San José. Costa Rica.
20. Franzluebbers, AJ. 2002. Soil organic matter stratification ratio as an indicator of soil 460 quality. Soil & Tillage Res. 66: 95-106.
21. Franzluebberz, AJ. 2008. Linking soil and water quality in conservation agricultural systems. Electronic Journal of Integrative Biosciences 6(1): 15-29.
22. Franzluebbers, AJ. 2010. Depth distribution of soil organic carbon as a signature of soil quality. 19th World Congress of Soil Science, Soil Solutions for a Changing World 1-6 August 2010, Brisbane, Australia. Published on DVD. http://www.ldd.go.th/swcst/Report/soil/symposium/pdf/2164.pdf
23. Galantini, JA; N Senesi; G Brunetti & R Rosell. 2004. Influence of texture on the nitrogen and sulphur status and organic matter quality and distribution in semiarid Pampean grassland soils. Geoderma 123: 143-152.
24. García Oliva, F; G Hernández & JF Gallardo Lancho. 2006. Comparison of ecosystem C pools in three forests in Spain and Latin America. Ann. For. Sci. 63 (2006) 519–523, INRA, EDP Sciences. DOI: 10.1051/forest: 2006034.
25. Gasparri, I & E Manghi. 2004. Estimación de volumen, biomasa y contenido de carbono de las regiones forestales Argentinas. Informe final. Unidad de Manejo del Sistema de Evaluación Forestal, Secretaría de Ambiente y Desarrollo Sustentable. Dirección de Bosques, República Argentina.
26. Giuffré, L; G Piccolo; R Romaniuk & J Prat. 2003. Deforestación y sistemas productivos en suelos de Misiones. http://www.estrucplan..ar/articulos/verarticulo. asp?IDArticu-lo=2876
27. Guo, LB & RM Gifford. 2002. Soil carbon stocks and land use change: A meta- analysis. Global Change Biology 8: 345-360.
28. IPCC. 2000. Land use, land-use change, and forestry special report. Cambridge University Press 377 pp.
29. Jinbo, Z; S Changchun & W Shenmin. 2007. Dynamics of soil organic carbon and its fractions after abandonment of cultivated wetlands in northeast China. Soil and Tillage Research 96, 350-360.
30. Karlen, DL; SS Andrews & JW Doran. 2001. Soil quality: current concepts and applications. Advances in Agronomy Volume 74: 1-39.
31. Kottek, M; Griecer,J; Beck,C: Rudolf,B and F Rubel. 2006. World Map of the Köppen-Geiger climate classification updated. Meteorol. Z., 15:259-263.
32. Lal, R 2001. Potential of soil carbon sequestration in forest ecosystem. In: Lal, R. (ed), Soil Carbon Sequestration and the Greenhouse Effect. Soil Science Society of America Special Publication, vol. 57. Madison, WI, 13-154.
33. Lal, R. 2004. Soil carbon sequestration to mitigate climate change. Review. Geoderma 123 (2004) 1-22.
34. Lupi, AM; ME Conti & RA Fernandez. 2012. Calidad del carbono orgánico del suelo en diferentes técnicas de manejo de residuos forestales. Ciência Florestal vol. 22, núm. 2, abril-junio, 2012, pp. 295-303.
35. Martiarena, RA; JL Frangi; A Von Wallis; MF Arturi; HE Fassola & RA Fernández. 2013. Propiedades del suelo y sus relaciones con el IS en plantaciones de Pinus taeda L. en la Mesopotamia Argentina. AUGMDOMUS, 6: 47-65, 2014. Asociación de Universidades Grupo Montevideo. ISSN: 1852-2181.
36. McBratney, AB & B Minasny. 2010. Comment on Determining soil carbon stock changes: Simple bulk density corrections fail. Agr Ecosyst Environ. 134: 251-256. Agr Ecosyst Environ 136:185-186.
37. Monreal, CM; JD Etchevers, M Acosta; C Hidalgo; J Padilla; RM López; L Jiménez; & A Veláquez. 2005. A method for measuring aboveand below-ground C stocks in hillside landscapes. Canadian Journal of Soil Science 85: 523-530.
38. Moraes Sá, JCD& R Lal. 2009. Stratification ratio of soil organic matter pools as an indicator of carbon sequestration in a tillage chronosequence on a Brazilian Oxisol. Soil and Tillage Research Volume 103, Pages 46-56. http://www.sciencedirect.com/science/article/pii/S0167198708001736. doi:10.1016/j.still. 2008.09.003.
39. Mórtola, NA. 2013. Comportamiento de las formas de fósforo en un Ultisol con diferentes manejos de implantación forestal. Tesis presentada para optar al título de Magister de la Universidad de Buenos Aires, Área Ciencias del Suelo Orientación Fertilidad de Suelos. Escuela para Graduados Ing. Agr. Alberto Soriano, UBA.
40. Nelson, DW & LE Sommers. 1996. Total carbon, organic carbon and organic matter. In: JM Bigham (ed). Methods of soil analysis, Part. 3. Chemical Methods. Pp. 961-493 1010. Am. Soc. Agron. & Soil Sci. Soc. Am. J., Madison, WI.
41. Piccolo, GA; AE Andriulo & B Mary. 2008. Changes in soil organic matter under different land management in Misiones province (Argentina). Sci. agric. (Piracicaba, Braz.) [online]. 2008, vol.65, n.3 [citado 2015-06-16], pp. 290-297. Disponible en: <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0103-90162008000300009&lng=es&nrm=iso>. ISSN 1678-992X. http://dx.doi.org/10.1590/S0103-90162008000300009.
42. Pinazo, MA; RA Martiarena; A Von Wallis; E Crechi; NM Pahr & O Knebel. 2007. Efectos de la intensidad de raleo sobre la compartimentalización y stock de carbono en plantaciones de Pinus taeda L. establecida sobre Ultisoles de Misiones. RIA. Revista de Investigaciones Agropecuarias abril, Vol. 36, N°1, INTA, Bs.As, Argentina. Pp. 5-20.
43. Porta Casanellas, J; C Lopez-Acevedo Reguerin & C Roquero de Laburu. 2003. Edafología para la agricultura y el medio ambiente. (3°ed.) S.A. Mundi-Prensa. ISBN 9788484761488. 929 pág.
44. Robert, M. 2002. Captura de Carbono en los Suelos para un Mejor Manejo de la Tierra. Food & Agriculture Org., 1 ene. 2002 - 61 páginas. Institut national de recherche agronomique, París. FAO.
45. Schumacher, BA. 2002. Methods for the determination of total organic carbon (TOC) in soils and sediments. United States Environmental Protection Agency Environmental Sciences Division National Exposure Research Laboratory. Las Vegas. http://www.epa.gov/esd/cmb/research/papers/bs116.pdf.
46. Solomon, D; F Fritzsche; J Lehmann; M Tekalign & W Zech. 2002. Soil organic matter dynamics in the subhumid agroecosystems of the Ethiopian highlands. Soil Sci. Soc. Am. J. 66:969-978. doi:10.2136/sssaj2002.0969.
47. Toledo, M; H Dalurzo & S Vazquez. 2010. Fosfatasa ácida en Oxisoles bajo cultivo de tabaco. CI Suelo (Argentina) 28(1): 33-38.
48. Toledo, M; JA Galantini; H Dalurzo; S Vazquez & G Bollero. 2013a. Methods for Assessing the Effects of Land Use Changes on Carbon Stocks of Subtropical Oxisols. Soil Sci. Soc. Am. J. 77: 1542-1552. doi:10.2136/sssaj2013.03.0087.
49. Toledo, DM; JA Galantini; E Ferrecio; S Arzuaga; L Gimenez & S Vazquez. 2013b. Indicadores e índices de calidad en suelos rojos bajo sistemas naturales y cultivados. Ciencia del Suelo (Argentina) 31(2): 201-212, 2013.
50. Torres Rojo, JM & A Guevara Sanginés. 2002. El potencial de México para la producción de servicios ambientales: captura de carbono y desempeño hidráulico. Instituto Nacional de Ecología. Gaceta Ecológica N° 63 pp 40-59. http://www.ine.gob.mx/veajei. /publicaciones/gacetas/63.
51. Turner, J & M Lambert. 2000. Change in organic carbon in forest plantation soils in Eastern Australia. Forest Ecol Manag.133: 231-247.
52. Uasuf, A & J Hilbert. 2012. El uso de la biomasa de Origen Forestal con destino a bioenergía en la Argentina. Informes Técnicos Bioenergía Año 1 Nº 3. ISSN 2250-8481. Trabajo del Instituto Nacional de Tecnología Agropecuaria (INTA) en el marco del proyecto internacional BABETHANOL (New feedstock and innovative transformation process for a more sustainable development and production of lignocellulosic ethanol).
53. Ussiri, D; R Lal & PA Jacinthe. 2006. Soil properties and carbon sequestration of afforested pastures in reclaimed mine soils of Ohio. Soil Sci. Soc. Am. J. 70:1797-1806. doi:10.2136/sssaj2005.0352.
54. Veldkamp, E.1994. Organic carbon turnover in three tropical soils under pasture after deforestation. Soil Sci. Soc. Am. J. 58: 175-180. doi: 10.2136/sssaj1994. 03615995005800010025x.
55. Zhao, F; G Yang; X Han; Y Feng & G Ren. 2014. Stratification of Carbon Fractions and Carbon Management Index in Deep Soil Affected by the Grain-to-Green Program in China. PLOS ONE 9(6): e99657. doi:10.1371/journal.pone.0099657.
56. Zinn, YL; DVS Resck & JE da Silva. 2002. Soil organic carbon as affected by forestation with Eucalyptus and Pinus in the Cerrado region of Brazil. Forest Ecol. Manag. 166: 285-294.
57. Zornoza, R; JÁ Acosta; F Bastida; SG Domínguez; DM Toledo & A Faz. 2015. Identification of sensitive indicators to assess the interrelationship between soil quality, management practices and human health. Soil: 1, 173-185, 2015. www.soil-journal.net/1/173/2015/ doi:10.5194/soil-1-173-2015.