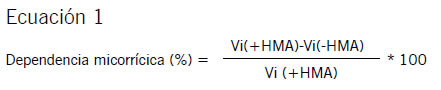
BIOLOGÍA DEL SUELO
Contribución de hongos micorrícicos nativos a la nutrición fosforada y su impacto en la partición de fotoasimilados de soja
Contribution of indigenous arbuscular mycorrhizal fungi to phosphorus nutrition and its effect on photoassimilates partitioning of soybean
Valeria S. Faggioli1; Cabello Marta2; Melchiorre N Mariana3; Covacevich Fernanda4*
1 Instituto Nacional de Tecnología Agropecuarias, EEA Marcos Juarez. Argentina
2 Instituto Spegazzini (Facultad de Ciencias Naturales y Museo, UNLP) - Comisión de Investigaciones Científicas de la Prov. de Buenos Aires. Argentina
3 Instituto Nacional de Tecnología Agropecuaria, Instituto de Fisiología y Recursos Genéticos Vegetales (IFRGV) del Centro de Investigaciones Agropecuarias (CIAP). Argentina
4 Instituto de Investigaciones en Biodiversidad y Biotecnología (INBIOTEC-CONICET)-FIBA, Mar del Plata; Instituto Nacional de ecnología
Agropecuaria, EEA Balcarce. Argentina
* Autor de contacto: covacevich.fernanda@inta.gob.ar
Recibido: 11/06/2019
Recibido con revisiones: 25/11/2019
Aceptado: 30/11/2019
RESUMEN
Estrategias de asociaciones entre plantas con hongos micorrícicos arbusculares (HMA) podrían ser utilizadas
para garantizar una eficiente nutrición de fósforo (P). Sin embargo, se desconoce si prácticas usuales de largo
plazo destinadas a la producción de soja en nuestro país, han deprimido el potencial de colonización y de promoción
de crecimiento vegetal por las comunidades de HMA nativos. Nuestro objetivo fue cuantificar el aporte
en crecimiento, absorción de P y partición de fotoasimilados en soja aportados por HMA nativos de monocultivo
de soja de larga duración ante oferta diferencial de P. Se instaló un ensayo en invernáculo durante 60 días con 4
tratamientos (con "+" y sin "-" HMA nativos de un monocultivo de soja de larga duración instalado en Córdoba;
con "+" y sin "-" fertilización con P por aplicación semanal de 15,5 mgP maceta-1). Los HMA nativos colonizaron
las raíces de soja y favorecieron su crecimiento aun cuando la oferta de P no fue limitante. La colonización
micorrícica intra y extra-radical, así como la oferta de P, favorecieron el crecimiento, la acumulación de P y el
contenido y la partición de azúcares en las plantas de soja. Las plantas crecidas en presencia de micorrizas
(+HMA) sin oferta de P (-P) mostraron mayor acumulación de materia seca y P. Aunque no se evidenció incremento
significativo en la absorción de P por las micorrizas, las plantas en la condición +HMA y +P mostraron
respuesta positiva a la micorrización en el crecimiento aéreo. Las plantas que crecieron ante +P y -HMA no
fueron las de mayor crecimiento. Esto resalta la importancia de favorecer prácticas de manejo que, combinadas
con la fertilización moderada destinada a la reposición de nutrientes, favorezca el mantenimiento de poblaciones
de HMA nativas que pueden contribuir a un uso más eficiente de la fertilidad del suelo y favorecer el crecimiento
del cultivo de soja.
Palabras claves: Simbiosis micorrícica, carbohidratos, colonización, fósforo
ABSTRACT
Association strategies between plants and arbuscular mycorrhizal fungi (AMF) could be used to ensure an efficient
phosphorus (P) nutrition. However, it is unknown if current long-term practices of soybean crop production
depressed potential for indigenous AMF colonization and growth promotion. Our objective was to assess the
contribution on growth, P uptake and photo-assimilate partitioning in soybean. A greenhouse trial (60 days) was
installed with 4 treatments (with "+" and without "-" AMF indigenous from a long-term soybean crop from Cordoba;
with "+" and without "-" P fertilization by weekly application of 15.5 mg P pot-1). Indigenous AMF colonized
soybean roots and favored plants growth even when the P supply was not limiting. The intra and extra-radical
presence of AMF as well as the supply of P, favored the growth, the accumulation of P and the content and the partition of sugars in the soybean plants. Plants that grew in the presence of mycorrhizae (+AMF) without
P supply (-P) showed increases in dry matter and accumulated P. Although there was no significant increase in
the P uptake by mycorrhizae, plants in the +AMF and +P condition showed a positive response to mycorrhizal
colonization in their aerial growth. Plants that grew in the -AMF and +P condition did not show higher growth.
This highlights the importance of management practices for soybean crop that, in combination with moderate P
fertilization aimed for nutrient replenishment; favor the maintenance of indigenous AMF activities.
Key words: Mycorrhizal symbiosis, carbohydrates, colonization, phosphorus
INTRODUCCIÓN
La baja disponibilidad del fósforo (P) en el suelo ha favorecido el desarrollo de diversas estrategias de las plantas para incrementar su capacidad de absorción (Marschner, 1995). Una de las estrategias más importantes y distribuidas en los ecosistemas es la formación de simbiosis micorrícicas. Los hongos micorrícico arbusculares (HMA, phylum Glomeromycota) habitan suelos tanto prístinos como agrícolas y establecen simbiosis con aproximadamente el 90% de las especies vegetales. Son reconocidos por su aporte a la nutrición fosforada de las plantas tanto por la mayor velocidad de absorción de P de las raíces, así como porque su micelio externo explora mayor volumen de suelo que las raíces no micorrizadas. La demanda de C del hongo a la planta constituye un gran destino de fotoasimilados, siendo el balance costo C/beneficio P el que resulta en promoción de crecimiento en las plantas micorrizadas (Smith & Read, 2010).
En la Argentina, la soja (Glycine max (L) Merr.) es el cultivo con mayor expansión habiendo llegado en 2017, a ocupar el 85% de la superficie sembrada de cultivos estivales (FAO, 2019). La soja presenta elevados requerimientos de P (6 kgP tn-1 grano) en comparación con otros cultivos. Las respuestas erráticas del cultivo a la fertilización fosforada y la ausencia de evidencias de mecanismos de solubilización de P orgánico tanto por la planta como por sus microorganismos simbiontes de la raíz, permite inferir que la soja posee estrategias para abastecerse de P del suelo (Marschner, 1995), tales como la formación de micorrizas. Sin embargo, se desconoce si prácticas usuales de largo plazo destinadas a la producción de soja en nuestro país, tales como el monocultivo, la fertilización y el uso de variedades resistentes al glifosato, entre otras, han afectado el potencial de colonización y de promoción de crecimiento de las comunidades de HMA nativas. El objetivo de este trabajo fue cuantificar el aporte al crecimiento, absorción de P y partición de fotoasimilados promovido por HMA nativas provenientes de suelos con monocultivo de soja implantado en la Provincia de Córdoba (Argentina) y la modulación de la respuesta ante oferta diferencial de P.
MATERIALES Y MÉTODOS
Caracterización del suelo
utilizado como sustrato
Se colectó suelo (Argiudol típico, profundo, franco arcillo limoso, capacidad de uso I) de un ensayo instalado en la EEA del INTA de Marcos Juárez (Córdoba, Argentina, 32°43"S. 62°06"O) en bloques completos al azar con cuatro repeticiones. Para esta investigación se colectó suelo a fines de septiembre, previo a la siembra del cultivo de soja, de parcelas mantenidas con monocultivo de soja en siembra directa y sin fertilización desde 1975. El suelo se colectó utilizando un excavador cilíndrico de 7,5 cm de diámetro y 10 cm de profundidad, con el cual se colectaron 20 "submuestras" por parcela en cada una de las repeticiones. Para homogeneizar las sub-muestras, el suelo se tamizó (5 mm malla) y se conformó una muestra compuesta con la totalidad del suelo obtenido. El material tamizado se conservó (4ºC) hasta su procesamiento, 15 días luego de la colecta.
La extracción de esporas de HMA se realizó por el método de tamizado en húmedo (Gerdemann & Nicolson, 1963) utilizando mallas de 110 μm y 74 μm, seguido de centrifugación en gradiente de sacarosa. Las esporas y esporocarpos de HMA se identificaron morfológicamente por microscopia óptica usando el sistema taxonómico propuesto por Schuβler & Walker (2010), por comparaciones con las descripciones de especies publicadas en el sitio web de International Culture Collection of Vesicular Arbuscular Mycorrhizal Fungi (INVAM, 2019) y material del cepario del Instituto Spegazzini (La Plata, Argentina).
Preparación y Diseño del experimento
Tratamientos
Se realizó un experimento en condiciones controladas conformado por cuatro tratamientos, resultantes de la combinación factorial de 2 niveles de HMA (+HMA, -HMA) y dos de fertilización fosforada (+P, aplicación semanal de 15,5 mgP maceta-1 y -P, sin aplicación de P) con 8 repeticiones.
La fuente de inóculo de los tratamientos +HMA fue el suelo extraído del monocultivo de soja a campo descripto anteriormente. Para la conformación del tratamiento -HMA se realizó la eliminación de los propágulos de HMA según Covacevich & Echeverría (2003). Brevemente, el suelo se incubó con formaldehido (Fh, 10 µl g-1 de suelo) durante 48 hs, y los gases del Fh fueron luego eliminandos con ciclos de vacío y recirculación de aire (Jenkinson & Powlson, 1976). En los tratamientos -HMA, se aplicaron 2 ml de filtrado (Whatman 589/3, 2,5 μm de poro, de acuerdo a Li et al. (2012) y al INVAM (2019) de suelo fresco a efectos de incorporar la microbiota nativa sin incluir propágulos de HMA. En los tratamientos de fertilización fosforada (+P) se aplicaron semanalmente 15,5 mgP maceta-1 a partir de una solución madre de 10 mM de K2PO4, durante 8 semanas.
Sustrato
Para componer el sustrato se mezcló suelo nativo del ensayo de campo (esterilizado o no con Fh según el tratamiento) con arena y perlita. La arena y perlita fueron enjuagadas separadamente con agua destilada presentando pH 6,5 y 7, respectivamente y sin trazas de P. Posteriormente, se tindalizaron (dos veces separadas por 48 hs) en autoclave a 121ºC durante 1 h.
Las unidades experimentales consistieron en macetas (1000 cc) que fueron llenadas en el centímetro superior con 100 g de arena, en la parte media con 555 g de una mezcla homogénea de arena: suelo (Fh o sin tratar según correspondía): perlita (100:10:1) y en el centímetro inferior con 100 g de una mezcla de arena: perlita (9:1). Previo a la siembra y fertilización (según correspondió) la porción media del sustrato de las macetas presentó una concentración de 8,7-10,2 mgP kg-1.
En cada componente del sustrato, se evaluó el contenido de P extractable, (Bray & Kurtz I), carbono orgánico (C, Walkley & Black) y pH en una mezcla suelo:agua (1:2,5 p/v) en cuatro sub-muestras de 100 g, de suelo, tratadas y no tratadas con Fh.
Plantas
Las semillas de soja (Glycine max (L) Merr. cv NS-4611) fueron desinfectadas previo a la siembra con una solución H2O2 al 10% y se pregerminaron en arena estéril a 25ºC durante 10 días. Una plántula de tamaño uniforme fue sembrada en cada maceta.
Las plantas de todos los tratamientos se fertilizaron cada 10 días con 50 mL de una solución conteniendo: macronutrientes (1 mM CaCl2.2H2O; 0,75 mM MgSO4 x 7H2O; 0,5 mM K2SO4, 15 mM ClNH4) y micronutrientes (10 µM H3BO3; 4 μM FeSO4 x 7H2O; 2 μM MnSO4 x H2O; 1 μM KI; 0,5 μM CuSO4 x 5H2O; 0,1 μM NaMoO4 x 2H2O; 0,2 μM CoCl2 x 6H2O). El experimento se mantuvo hasta los 60 días después de la siembra (DDS) en invernáculo, bajo luz natural durante los meses de octubre y noviembre, a 25ºC (± 5ºC).
Determinaciones en planta y sustrato
Biomasa, conce.ntración de P
y de azúcares en planta
A los 60 DDS se determinó, en 4 repeticiones de cada tratamiento, la altura, peso fresco y seco aéreo y de raíces y número y peso de nódulos en la raíz principal. El material seco aéreo y radical se molió (0,5 mm) y se utilizó para la determinación del contenido de P (Murphy & Riley, 1962).
El contenido de azúcares solubles e insolubles se determinó tanto en la primera hoja trifoliada totalmente expandida como en raíces, usando material fresco de las restantes 4 repeticiones de cada tratamiento por hidrólisis con de H2SO4 e incubación con antrona de acuerdo a Leyva et al. (2008).
Se estimó la dependencia micorrícica de las plantas de soja para cada condición de oferta de P de acuerdo a Ecuación 1 (Plenchette et al., 1983).
Donde, Vi: diferentes variables (altura de plantas, biomasa y concentración de P y de azúcares) cuantificadas para las condiciones +HMA y -HMA.
Colonización y viabilidad micorrícica en raíces
La colonización de HMA se evaluó por clarificación y tinción de un gramo de raíces con azul de tripán en lactoglicerol de acuerdo a Phillips & Hayman (1970) omitiendo el uso de fenol. La viabilidad de las estructuras fúngicas se determinó por la actividad de la enzima succinato deshidrogenasa (Kough et al., 1987). Para cada tinción, se realizó el recuento por observación microscópica (50X) de estructuras de HMA presentes en las raíces en 90 intercepciones por muestra (McGonigle et al., 1990).
Determinaciones en el sustrato
Se cuantificó la longitud de las hifas extra radicales de HMA (Hart & Reader, 2002) por dispersión del sustrato en (NaPO3)6, resuspensión del pellet en glicerol, tinción con azul de tripán y decantación del material en filtros (AC Whatman GD/X de 0,45 μm de poro). La cuantificación en microscopio óptico (50X) en 100 intercepciones de los portaobjetos permitió calcular la longitud de hifas por gramo de suelo según la Ecuación 2 (Newman, 1966).
Donde, H: longitud de hifas (mm), N: número de intercepciones, A: área del filtro, L: longitud de la línea de intercepto del objetivo del microscopio.
Además, se determinó el contenido del P extractable (Bray & Kurtz I) del sustrato.
Análisis estadísticos
Para cumplir el supuesto de normalidad, los datos de porcentaje de micorrización y viabilidad de estructuras micorrícicas fueron transformados por arcoseno de la raíz cuadrada de la variable. Los datos se analizaron mediante ANOVA, cuando las interacciones o alguno de los efectos individuales resultaron significativos (p<0,05), las medias se compararon mediante test Tukey. Las mediciones relacionadas con la concentración y acumulación de P se compararon mediante contrastes ortogonales entre las medias de +HMA y -HMA para cada situación de oferta de P. Todos los análisis se realizaron con el software Infostat (Di Rienzo et al., 2014).
RESULTADOS Y DISCUSIÓN
Caracterización y presencia de
HMA en el suelo-sustrato
En el suelo proveniente del ensayo de larga duración con monocultivo de soja, se identificaron morfológicamente HMA nativas que correspondieron a las especies: Acaulospora mellea (Schenk); Acaulospora scrobiculata (Trappe); Claroideoglomus etunicatum (Becker & Gerdemann; Schuβler & Walker) y Rhizophagus intraradices (Schenk & Smith; Schuβler & Walker). Estas especies son comunes para suelos de uso agrícola de la pampa argentina asociadas a cultivos de importancia agrícola incluyendo soja (Schalamuk et al., 2013; Faggioli et al., 2019).
La fumigación del suelo con formaldehido para la erradicación de propágulos de HMA (utilizado en los tratamientos -HMA) no modificó los contenidos de P extractable, C carbono orgánico ni de pH (Tabla 1).
Tabla 1. Propiedades químicas del suelo antes (+HMA)
y después (-HMA) del tratamiento con formaldehido
(± Error Estándar).
Table 1. Chemical properties of the soil before (+ HMA) and
after (-HMA) formaldehyde soil treatment (± Standard Error).
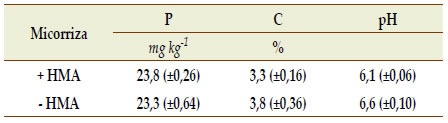
+HMA y -HMA corresponden a suelo sin y con tratamiento de fumigación
con formaldehído, respectivamente. P: fósforo extractable; C: carbono
orgánico; pH: relación suelo:agua 1:2,5
+ HMA and -HMA correspond to soil without and with fumigation
treatment with formaldehyde, respectively. P: extractable phosphorus; C:
organic carbon ; pH: soil: water ratio 1: 2,5
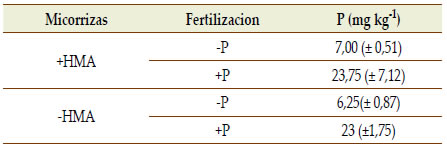
A través del suministro de P, se logró mantener el nivel inicial de P del sustrato durante los 60 días de duración del experimento (Tablas 1 y 2), alcanzando un contenido de P a la finalización del experimento en el sustrato de las macetas hasta tres veces mayor en relación a los tratamientos que no recibieron el nutriente (Tabla 2). Para cada condición de suministro de P, la presencia de HMA no afectó el contenido de P en el sustrato (Tabla 2).
Tabla 2. Fósforo (P) extractable en el sustrato de crecimiento
de plantas de soja a los 60 DDS, en presencia (+HMA) y
ausencia (-HMA) de micorrizas, sin (-P) o con (+P) suplemento
semanal de P (15, 5 mg P maceta-1). (± Error Estándar).
Table 2. Extractable phosphorus (P) at the substrate of
soybean plants of 60 DAS with (+HMA) and without
(-HMA) mycorrhizae, without (-P) or with (+P) weekly
supplementation of P (15, 5 mg P pot-1). (± Standard Error)
La presencia de micorrizas en soja sólo se registró en las plantas que crecieron en la condición +HMA, evidenciando la eficiencia del tratamiento con Fh. En este estudio, se realizó además una modificación a la técnica original, eliminando los vapores de Fh a través de recirculación forzada de aire. Esto disminuyó los períodos de ventilación de aproximadamente 30 días (según el volumen de suelo en la técnica original de Covacevich & Echeverría, 2003), a 48 h. En la condición -P, el grado de colonización no vital por HMA superó significativamente al registrado en la condición +P (Figura 1a). El suministro de P deprimió, aunque no inhibió, el establecimiento de la micorrización, detectándose reducciones de la colonización intra-radical del 33% de hifas y del 40% de arbúsculos respecto de la condición -P (Figura 1a). La viabilidad de las hifas y arbúsculos, fue significativamente (p < 0,05) superior en la condición -P en relación con la +P y mayores a las registradas luego de la tinción no vital (Figura 1b). En este sentido, las hifas y arbúsculos viables en la condición -P superaron 2 y 5 veces respectivamente, las observadas en la condición +P. Paradójicamente, el número de vesículas viables en la condición +P prácticamente duplicó el número registrado en la condición -P (Figura 1b). Esto podría asociarse a que las vesículas constituyen estructuras de almacenamiento (Müller et al., 2017), por lo que ante una condición de suficiencia de nutrientes, la proliferación de estas estructuras podría verse favorecida. Nijjer et al. (2010) observaron que los HMA destinaron cuatro veces más recursos al desarrollo de las vesículas en condiciones de fertilización.
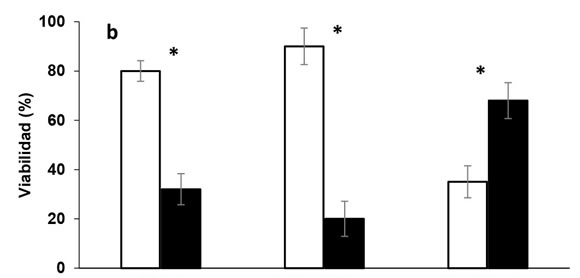
Figura 1. Colonización (a) y viabilidad (b)
de hifas, arbúsculos y vesículas en raíces
de soja con oferta diferencial de P (-P, +P)
para la condición +HMA. Barras sobre
columnas indican error estándar. El asterisco
(*) representa diferencias estadísticamente
significativas entre niveles de P en cada
estructura fúngica (Tukey, p < 0,05).
Figure 1. Colonization (a) and viability (b) of
hyphae, arbuscules and vesicles in soybean
roots with differential supply of P (-P, + P) in
+HMA condition. Bars on columns indicate
standard error. The asterisk (*) represents
statistically significant differences between
levels of P in each fungal structure (Tukey, p <
0.05).
La oferta de P disminuyó la longitud de las hifas extra-radicales, en el tratamiento -P las hifas fueron 2,7 veces más largas que en la condición +P lo cual representa un 60% más de capacidad de exploración por unidad de masa de sustrato en el tratamiento -P respecto a +P (Figura 2). Nuestros resultados confirman que la regulación de la simbiosis micorrícica en soja está fuertemente modulada por la oferta de P puesto que la oferta del nutriente fue determinante del grado de colonización, viabilidad y densidad de hifas extra-radicales asociadas a plantas de soja. Uno de los mecanismos más citados sobre la regulación del proceso de micorrización en plantas en condiciones de alta oferta de P, es la supresión de la asignación de fotosintatos al hongo (Javot et al., 2007). Dicho mecanismo explicaría la pérdida de viabilidad de las estructuras fúngicas presentes en las raíces ante oferta de P, lo que sugeriría un doble control de las plantas sobre las HMA, ya sea inhibiendo parcialmente los niveles de micorrización o disminuyendo la vida media de las estructuras intra-radicales. Contrariamente, en condiciones -P se evidenció mayor colonización y actividad de las estructuras micorrícicas intra-radicales. Es posible inferir, entonces, que en -P hubo mayor asignación de fotoasimilados que en +P para sostener las estructuras micorrícicas intra-radicales, así como el micelio extraradical, ampliando la superficie de exploración del suelo. En comparación con los pelos radicales, el reducido diámetro que poseen las hifas les permite una mayor superficie específica de exploración y más eficiencia en su capacidad de absorción de P por unidad de C (Smith & Read, 2010).
Respuestas a la micorrización: Crecimiento, contenido de P y acumulación de azúcares El peso seco aéreo de plantas, número y peso de nódulos de plantas de soja a los 60 DDS ante la condición +P y en presencia o ausencia de HMA nativas, fue significativamente mayor respecto de los tratamientos -P y -HMA, sin diferencias en la biomasa de raíces (Tabla 3). Para ambas condiciones de P, las plantas en los tratamientos sin micorrizas desarrollaron nódulos a niveles comparables a los obtenidos en plantas con micorrizas (Tabla 3). Es probable que la reposición de la microbiota (carente de propágulos de HMA) efectuada al momento de la siembra a partir de un extracto de suelo filtrado, haya permitido restablecer, al menos parcialmente, las rizobacterias simbióticas y probablemente también otros microrganismos benéficos promotores de crecimiento vegetal (PGPR). Además, en estudios preliminares detectamos que la fumigación con Fh del suelo no elimina las rizobacterias formadoras de nódulos (datos no mostrados). Consideramos que el agregado de filtrado de suelo incorporó, además de rizobacterias formadoras de nódulos, otros componentes de la microbiota tales como las "mycorrhizae helper bacteria" las que son claves para el desarrollo y el establecimiento de las simbiosis micorrícicas (Deveau & Labbé, 2016).
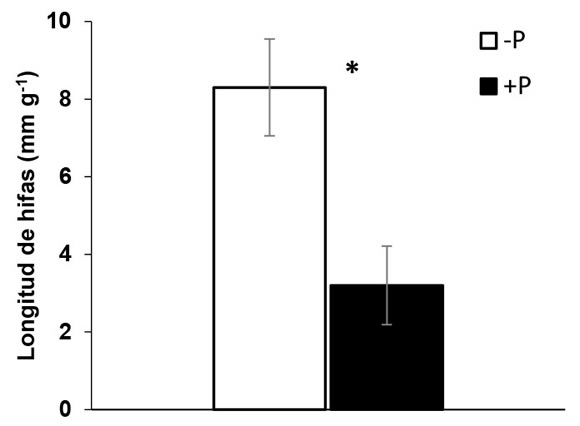
Figura 2. Longitud de hifas de Glomeromycota en la
rizósfera de plantas de soja con oferta diferencial de P
(-P, +P) para la condición +HMA. Barras sobre columnas
indican error estándar (n=4). Asterisco (*) indica
diferencias estadísticamente significativas entre niveles
de P (Tukey, p < 0,05)
Figure 2. Length of Glomeromycota hyphae in soybean
rhizosphere with differential supply of P (-P, + P) in
+HMA condition. Bars indicate standard error (n = 4).
Asterisk (*) represents statistically significant differences
between P levels (Tukey, p < 0.05).
Tabla 3. Altura, y biomasa aérea, radical y de nódulos de plantas de soja de 60 días crecidas en presencia (+HMA) o ausencia
(-HMA) de propágulos micorrícicos nativos y oferta diferencial de P (+P, -P) y resultados del ANOVA.
Table 3. Height, weight and nodulation of soybean plants after 60 days of growth in the presence (+ HMA) or absence (HMA) of
native mycorrhizal propagules and differential P supply (+ P and -P). Mean values (n = 4) and ANOVA results.

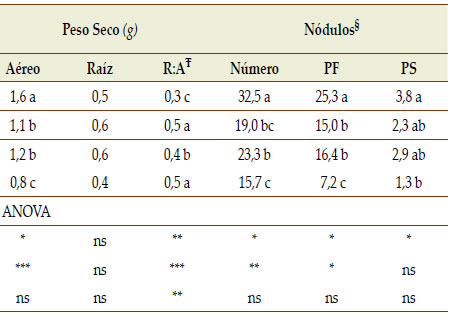
Ŧ R:A relación entre la biomasa acumulada por tejidos radicales (R) y aéreos (A).
§Nódulos: Número (nódulos planta-1); PF: Peso fresco (mg nódulo-1); PS: Peso seco (mg nódulo-1)
Resultados de ANOVA: * p < 0,05; ** p < 0,01¸*** p < 0,001; ns: no significativo
Para cada parámetro, letras distintas indican diferencias significativas según test Tukey (p < 0,05).
Ŧ R: A relationship between root (R) and aerial (A) accumulated biomass.
§Nodules: Number (nodules plant-1); PF: Fresh weight (mg nodule-1); PS: Dry weight (mg nodule-1)
Results of ANOVA: * p < 0.05; ** p < 0.01¸ *** p < 0.001; ns: non-significant.
For each parameter, different letters indicate significant differences according to the Tukey test (p <0.05).
Ha sido reportado que distintos cultivos crecidos bajo adecuada provisión de P y otros nutrientes manifestaron mejoras en el crecimiento en presencia de micorrizas, especialmente en leguminosas (Plenchette et al., 1983). Para soja se ha reportado promoción de crecimiento como respuesta a la inoculación con cepas individuales de HMA ante oferta diferencial de P (Kelly et al., 2001; Abdel-Fattah et al., 2014). Fernandez et al. (2011) reportaron efectos positivos por la inoculación con HMA nativos del centro-norte de la Provincia de Buenos Aires (Alberti) en plantas de soja, tanto en condiciones de baja como de media disponibilidad de P en el sustrato. Nosotros confirmamos los estudios previos, y destacamos la importancia de la inoculación con HMA nativos de ensayos de larga duración con monocultivo de soja. Meghvansi et al. (2008) reportaron cierta preferencia en la promoción de crecimiento de plantas de soja por la inoculación con G. intraradices con relación a la inoculación simple o combinada con Acaulospora tuberculata y Gigaspora gigantea. Nosotros inoculamos con un consorcio de HMA nativos que si bien su conformación de Glomeromycota fue identificada, desconocemos si una especie de HMA favoreció más el crecimiento que otra. Además, nuestros resultados parecen indicar que el suministro de P proporcionado resultó en una condición de suficiencia del nutriente sin deprimir la colonización ni el beneficio de la simbiosis nativa en soja. Asimismo, otras interacciones benéficas de la micorrizosfera no analizadas en este estudio podrían haber contribuido a promover el crecimiento vegetal cuando la colonización micorrícica se vio reducida.
La relación entre la biomasa de raíces y la biomasa aérea (R:A) fue mayor ante la condición -P así como para la condición -HMA (Tabla 3). Esto evidencia el diferencial destino de fotoasimilados, el cual demostró haber aumentado hacia raíz ante deficiencia de P y/o ausencia de HMA, probablemente para favorecer una mayor exploración del suelo por las raíces. La relación R:A ha presentado en ocasiones resultados contradictorios que han sido compilados en un meta-análisis publicado por Maherali (2014). En ocasiones, la competencia entre el hongo y la raíz por los fotoasimilados podría ser el principal factor responsable de una menor proporción de peso de raíces que de órganos aéreos en plantas micorrizadas. En consecuencia, es probable que ante una baja oferta de P en el suelo, las plantas asignen mayor proporción de la biomasa a los órganos radicales, lo cual podría traducirse en una mayor relación R:A (Ciereszko et al., 1996). En nuestro estudio determinamos que en ausencia de fertilización fosforada (-P) la biomasa aérea en presencia de micorrizas (+HMA) fue 25% mayor a la registrada en el tratamiento -HMA, poniendo de manifiesto el efecto de compensación promovido por la simbiosis en condiciones nutricionales limitantes. Nuestros resultados confirman reportes previos y ponen en evidencia el efecto benéfico y significativo colonización por HMA, aún en condiciones no limitantes de nutrientes evidenciándose por una mayor relación R:A asi como por la promoción de desarrollo de hifas HMA que permitirían una mayor exploración del suelo.
La concentración de P en las plantas fue significativamente mayor en los tratamientos fertilizados que en los tratamientos -P. En la situación con +HMA, la concentración de P en parte aérea y raíces en las plantas que recibieron P fue 14 veces superior al tratamiento sin aporte de P (Figura 3). Asimismo, en ausencia de micorrizas (-HMA), la concentración de P en parte aérea y raíces fue 16 y 62 veces superior, respectivamente, en relación a los tratamientos que no recibieron fertilización fosforada (Figura 3). Para cada condición de P, no se registraron diferencias significativas en la concentración de P por la presencia de HMA, excepto en raíces que crecieron en deficiencia de P y en la condición +HMA, situación en que la concentración de P triplicó la registrada en la condición sin micorrizas (Figura 3d).
La acumulación de P en las plantas de soja (i.e para raíces y órganos aéreos: concentración de P x peso de la planta) fue afectada (p< 0,05) por el suministro de P (P acumulado aéreo= 6,815 y 0,35 mg P planta-1; P acumulado raíz= 2,86 y 0,13 mg P planta-1, para cada órgano valores corresponden a los promedios de P acumulado para la condición +P y -P respectivamente). En la condición +HMA, la acumulación de P en parte aérea y raíces en plantas que recibieron P fue 20 y 10 veces superior al tratamiento sin aporte de P, respectivamente. Asimismo, en la condición -HMA, la acumulación de P en parte aérea y raíces fue 20 y 77 veces superior en los tratamientos +P respectivamente a los tratamientos -P (Figura 4). El P acumulado en órganos aéreos mostró resultados marginalmente significativos (p<0,08) en la situación +P como resultado de la presencia de HMA (Figura 4a), mientras que no se detectaron diferencias por la presencia de HMA en la condición -P (Figura 4b). Para la acumulación de P en raíces se detectaron repuestas significativas y opuestas según la condición de oferta de P e inoculación con HMA. En la situación +P, las raíces micorrizadas acumularon 30% menos P por planta que las no micorrizadas (Figura 4c). Contrariamente, ante condición -P, las raíces micorrizadas acumularon 5,5 veces más P que las no micorrizadas (Figura 4d). Las concentraciones de P halladas en las plantas de la condición +P fueron al menos un orden de magnitud superior al promedio de los tratamientos -P y los valores registrados en este trabajo son similares a los reportados por otros autores (Fredeen & Terry, 1988; Lendenmann et al. 2011).
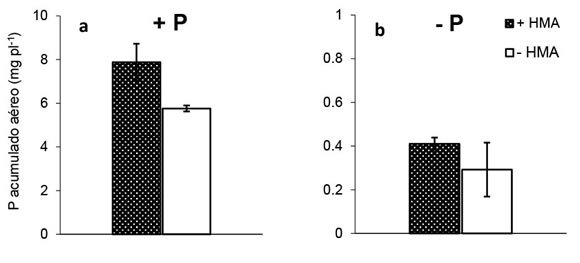
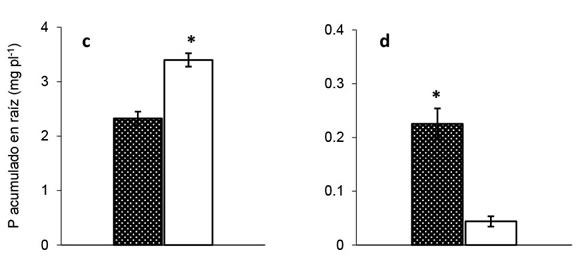
Figura 3. Concentración de P de tejidos aéreos
(a y b) y radicales (c y d) de plantas de soja (60
DDS) crecidas en dos niveles de oferta de P
(+P y -P) y con o sin propágulos micorrícicos
nativos de hongos micorrícicos arbusculares
(+HMA, -HMA, respectivamente). Barras
sobre columnas indican error estándar (n=4).
Asterisco (*) indica, para cada nivel de P,
diferencias estadísticamente significativas
entre +HMA y -HMA (contrastes ortogonales,
p < 0,001).
Figure 3. Phosphorous concentration at aerial
(a, b) and root tissues (c, d) in soybean plants
at 60 DAS growing with two P supply levels
(+P, -P) and with or without indigenous
arbuscular mycorrhizal fungi (+HMA, -HMA,
respectively). The bars indicate standard error
(n=4). Asterisk (*) indicates in each P level
statistically significant differences between
+HMA and -HMA (orthogonal,
p < 0,001).
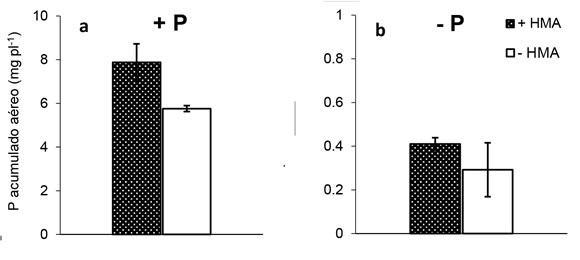
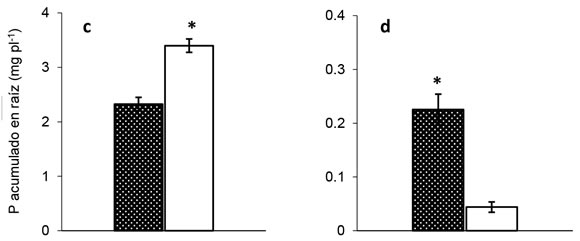
Figura 4. Acumulación de P de tejidos aéreos (a y b) y radicales (c y d) de plantas de soja (60 DDS) crecidas en dos niveles de oferta
de P (+P y -P) y con o sin propágulos micorrícicos nativos de hongos micorrícicos arbusculares (+HMA, -HMA, respectivamente).
Barras sobre columnas indican error estándar (n=4). Asterisco (*) indica, para cada nivel de P, diferencias estadísticamente
significativas entre +HMA y -HMA. (contrastes ortogonales, p < 0,001).
Figure 4. Phosphorous accumulation in aerial (a, b) and root tissues (c, d) in soybean plants (60 DAS) growing with two P supply levels
(+P, -P) and with or without indigenous arbuscular mycorrhizal fungi (+HMA, -HMA, respectively). The bars indicate standard error (n=4).
Asterisk (*) indicates in each P level statistically significant differences between +HMA and -HMA (orthogonal contrasts, p <0.001).
La partición de fotoasimilados es una de las propiedades más afectadas por la deficiencia de P. Cantidades sub-óptimas del nutriente disminuyen la tasa de fijación de dióxido de carbono y la expansión de la superficie fotosintética foliar (Brooks, 1986). La baja concentración de P en el citoplasma tiene consecuencias sobre el metabolismo de los azúcares, particularmente en la fotosíntesis, glicólisis y respiración (Plaxton & Carswell, 1999). Como consecuencia de la disminución de la demanda para crecimiento y respiración, los azúcares insolubles, y principalmente el almidón, comienzan a acumularse (Pieters et al., 2001). En plantas de soja, se ha observado un incremento en la concentración de almidón en hojas y raíces, mientras que los azúcares solubles tienden a alojarse principalmente en la raíz (Fredeen & Terry, 1988). En plantas micorrizadas estos patrones de asignación de carbohidratos se ven modificados por la demanda de C del hongo (Graham et al., 1997). Por lo general, la presencia de micorrizas está correlacionada con una reducción en la concentración de hidratos de carbono solubles, mientras que el efecto sobre los azúcares insolubles puede o no ser detectado (Douds et al., 2000).
En ambientes con bajos niveles de P disponible, el efecto inmediato de la micorrización es una mejora en la nutrición de las plantas (Smith & Read, 2010). En nuestro estudio la partición de fotoasimilados se analizó luego de la cuantificación de azúcares solubles e insolubles en órganos aéreos y radicales de la planta. Nuestros resultados confirmarían parcialmente la observación de Smith & Read (2010), dado que el efecto promotor por la formación de micorrizas en los tratamientos sin suministro de P se manifestó con aumentos significativos de la concentración y acumulación de P en las raíces (Figuras 3d y 4d), en el peso aéreo y en el peso de nódulos, incrementando también de manera marginal la altura de las plantas y el número de nódulos (Tabla 3). En cuanto a la concentración de azúcares solubles del tejido foliar, se observó una interacción significativa (p < 0,05) entre HMA*P, mientras en las raíces se hallaron diferencias altamente significativas en respuesta a P (p < 0,001) y también significativas en respuesta a la condición HMA (Tabla 4). En concordancia con lo reportado por otros autores (Douds et al., 2000; Graham et al., 1997), en +HMA +P se obtuvo la menor concentración de azúcares solubles tanto en tejido foliar como en raíces. En ausencia de limitantes nutricionales (+P) en plantas micorrizadas se estimularía la fotosíntesis así como la demanda de carbohidratos rápidamente asimilables con destino hacia la raíz para el mantenimiento de la simbiosis micorrícica; ésto podría manifestarse como una merma en la concentración de azúcares solubles en la parte aérea (Jakobsen, 1995). En nuestro estudio las plantas de soja con limitaciones de P y en ausencia de micorrizas (-HMA -P) presentaron elevada concentración de azúcares solubles en la raíz y bajo nivel de azúcares insolubles (almidón) en hojas (Tabla 4). En esta condición, el aumento de la concentración de azúcares insolubles podría deberse a disminuciones del crecimiento de la planta. Asimismo, la mayor concentración de azúcares solubles en raíz po - dría explicarse por la movilización de los azúcares hacia dicho órgano para favorecer su desarrollo e incrementar la exploración del suelo como una estrategia de subsanar el déficit de P (Douds et al., 2000), así como para garantizar el mantenimiento de la simbiosis micorrícica. En las condiciones -P +HMA y +P -HMA el contenido de azúcares solubles e insolubles tanto en hojas como raíces no fue diferente (Tabla 4), lo que permitiría inferir que la presencia de micorrizas en condiciones de déficit de P podría haber promovido una asignación de fotoasimilados compensando el nivel alcanzado por una planta que creció sin deficiencias del nutriente. En general, nuestros resultados corroboran la importancia del P en el metabolismo de los azúcares y el efecto de las micorrizas en cuanto a su demanda desde la raíz.
Tabla 4. Concentración de azúcares (Az.) solubles e insolubles en parte aérea fresca (PF) y raíces de plantas de soja (60 DDS)
crecidas en dos niveles de oferta de P (+P y -P) y con o sin propágulos micorrícicos nativos de hongos micorrícicos arbusculares
(+HMA, -HMA, respectivamente). Se muestran los valores medios y los resultados de ANOVA.
Table 4. Soluble and insoluble sugars (Az.) in fresh (PF) aerial and root soybean tissue (60 DAS) growing with two P supply levels
(+P, -P) and with or without indigenous arbuscular mycorrhizal fungi (+HMA, -HMA, respectively). Mean values and ANOVA
results are shown.
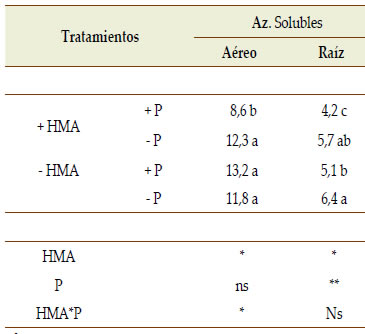
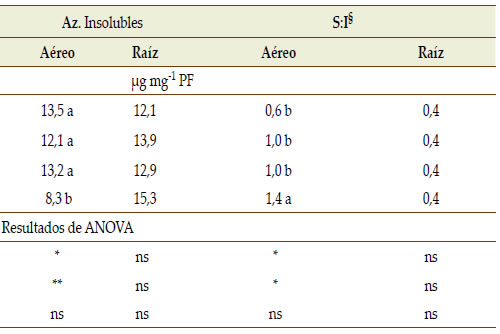
§ Relación entre la concentración de azúcares solubles y almidón
Resultados de ANOVA: *p < 0,05; ** p < 0,001; ns: no significativo
Letras distintas indican diferencias significativas según test Tukey (p < 0,05)
§ Relationship between soluble sugars and starch concentrations
Results of ANOVA: *. p <0.05; ** P <0.001; ns: non-significant
Different letters indicate significant differences according to the Tukey test (p < 0.05)
La dependencia micorrícica (DM) es un índice propuesto por Plenchette et al. (1983) para estimar el grado de respuesta de una planta a la presencia de micorrizas. Valores mayores que cero indican una mejor performance de la planta en la condición +HMA en comparación con la condición -HMA. Nuestros resultados indican que los tejidos radicales tuvieron una mayor respuesta a la micorrización que los aéreos y que la respuesta fue afectada significativamente por la oferta de P. En este sentido, tanto el peso, como la concentración y acumulación de P de raíces tuvieron DM positiva en la condición -P, y negativa en +P (Figura 5). Este resultado corrobora el rol de las micorrizas para las leguminosas en términos de la partición de biomasa y nutrientes, independientemente de la oferta de P (Safir et al., 1972; Fredeen & Terry, 1988). La DM negativa en la concentración de azúcares solubles e insolubles en la condición +P, y en la relación de azúcares S:I en hojas, en ambas ofertas de P (+P y -P) (Figura 6), puede atribuirse directamente a la demanda de C por parte del hongo (Tinker et al., 1994). Es decir, es un indicador de la presencia de la simbiosis incluso en la situación de mayor suministro de P.
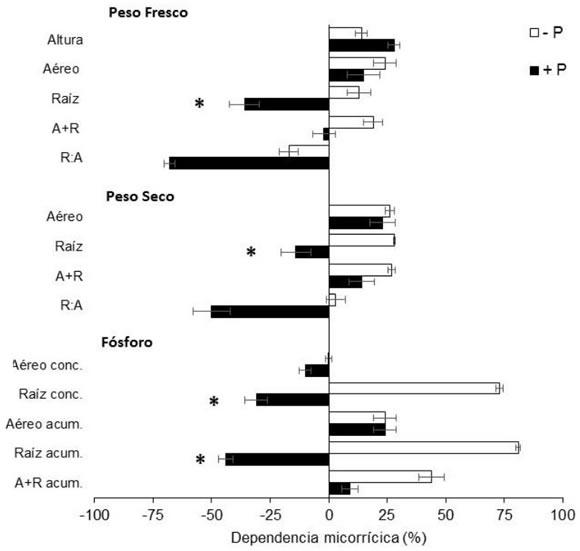
Figura 5. Dependencia micorrícica (%) de
plantas de soja (60 DDS) ante dos niveles de
oferta fosforada (+P y -P). Concentración
de P (mg.g-1) y acumulación de P (mg.
pl-1) en parte aérea y raíces; suma de
acumulación de P en las fracciones aéreas
y radicales (A+R). Barras corresponden al
error estándar. Asteriscos (*) representan
diferencias estadísticamente significativas
entre condición de fertilización (ANOVA,
p < 0,05).
Figure 5. Mycorrhizal dependence (%)
of soybean plants at 60 DAS under two
levels of phosphorus supply (+ P and -P); P
concentration (mg g-1) and P accumulation
(mg.pl-1) in aerial and roots tissues; Sum
of P accumulated in aerial part and roots
(A + R). Bars indicate standard error.
Asterisks (*) indicate statistically significant
differences between P supply condition
(ANOVA, p < 0.05).
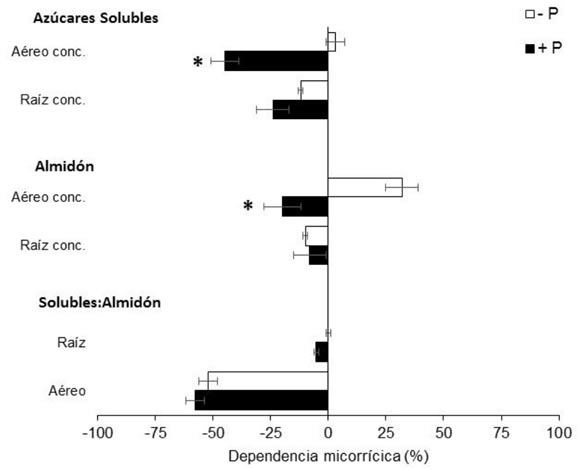
Figura 6. Dependencia micorrícica (%)
de plantas de soja (60 DDS) bajo dos
niveles de oferta fosforada (+P y -P).
Azúcares solubles e insolubles en parte
aérea y raíces. Las barras corresponden al
error estándar. Asteriscos (*) representan
diferencias estadísticamente significativas
entre condición de fertilización (ANOVA,
p<0,05).
Figure 6. Mycorrhizal dependence (%) in
soybean plants at 60 DAS under two levels
(+ P and -P) of phosphorus supply: Soluble
and insoluble sugars in aerial and roots
tissues. The bars correspond to the standard
error. Asterisks (*) indicate statistically
significant differences between P supply
condition (ANOVA, p<0,05).
CONCLUSIONES
A partir de suelo proveniente de historial de monocultivo de soja, en este trabajo se confirmó la presencia de propágulos de HMA capaces de colonizar raíces de soja y favorecer su crecimiento aun cuando la oferta de P no fue limitante. En +P +HMA, las plantas mostraron una respuesta positiva a la micorrización en su crecimiento aéreo, pero estas no absorbieron más P que las de la condición -HMA. La fertilización con P generó una disminución de la producción extraradical de hifas y en la viabilidad de las estructuras fúngicas. Sin embargo, la demanda de azúcares de la simbiosis micorrícica demostró no haber generado depresión del crecimiento ni efectos negativos en la planta. Las plantas que crecieron en -P -HMA no fueron las de mejor performance, resaltando la importancia de favorecer prácticas de manejo que, combinadas con la fertilización, favorezcan el mantenimiento de poblaciones de HMA nativas que pueden contribuir a un uso más eficiente de la fertilidad del suelo y favorecer el crecimiento vegetal.
AGRADECIMIENTOS
Los autores agradecen al Dr Hernán Lascano y su equipo del Insituto de Fisiología y Recursos Genéticos Vegetales (INTA) por su asesoramiento metodológico, a la Dra Dannae Serri por su colaboración en las determinaciones de laboratorio, y a la Ing. María Beatríz Formica de INTA EEA Marcos Juárez por facilitar las instalaciones para realizar el experimento. Este trabajo fue financiado con fondos de proyectos INTA (2019-PD-E2- I037-002), del Foncyt (PICT 2015-0392) y de CONICET (PIP0424).
REFERENCIAS
1. Abdel-Fattah, G; A Wasea Asrar; SM Al-Amri & EM Abdel-Salam. 2014. Influence of arbuscular mycorrhiza and phosphorus fertilization on the gas exchange status, growth and nutrients content of soybean (Glycine max L.) plants grown in a sandy loam soil. Journal of Food Agriculture and Environment 12: 150-156.
2. Brooks, A. 1986. Effects of phosphorus nutrition on ribulose-1, 5-bisphosphate carboxylase activation, photosynthetic quantum yield and amounts of some Calvin- cycle metabolites in spinach leaves. Functional Plant Biology 13: 221-237.
3. Ciereszko, I; A Gniazdowska; M Mikulska & AM Rychter. 1996. Assimilate translocation in bean plants (Phaseolus vulgaris L.) during phosphate deficiency. Journal of Plant Physiology 149: 343-348.
4. Covacevich, F & HE Echeverria. 2003. Utilización de formaldehido para la erradicacion de hongos micorriticos arbusculares de muestras de suelo. Ciencia del Suelo 21: 9-17.
5. Deveau, A & J Labbé. 2016. Mycorrhiza helper bacteria. En: Martin, F. (Ed.) Molecular Mycorrhizal Symbiosis, First Edition. Wiley, J. & Sons, Inc. Published. Chapter 24: 437-450.
6. Di Rienzo, JA; F Casanoves; MG Balzarini; L Gonzalez; M Tablada & CW Robledo. 2014. InfoStat version 2014. Grupo InfoStat. En: Facultad de Ciencias Agrarias, Universidad Nacional de Córdoba, Argentina.
7. Douds Jr, DD; PE Pfeffer & Y Shachar-Hill. 2000. Carbon partitioning, cost, and metabolism of arbuscular mycorrhizas. Arsbuscular mycorrhizas: physiology and function: Springer,107-129.
8. FAO (Food and Agriculture Organization). 2019. FAOSTAT. Organización de las Naciones Unidas para la Alimentación y la Agricultura. www.fao.org/faostat/
9. Faggioli, VS; MN Cabello; G Grilli; M Vasar; F Covacevich & M Öpik. 2019. Root colonizing and soil borne communities of arbuscular mycorrhizal fungi differ among soybean fields with contrasting historical land use. Agriculture, Ecosystems and Environment 269: 174-182 https:// doi.org/10.1016/j.agee.2018.10.002
10. Fernández, MC; FH Gutiérrez Boem & G Rubio. 2011. Effect of indigenous mycorrhizal colonization on phosphorusacquisition efficiency in soybean and sunflower. Journal of Plant Nutrition and Soil Science. 174: 673-677 DOI: 10.1002/jpln.201000109 673
11. Fredeen, AL & N Terry. 1988. Influence of vesicular-arbuscular mycorrhizal infection and soil phosphorus level on growth and carbon metabolism of soybean. Canadian Journal of Botany 66: 2311-2316.
12. Gerdemann, JW & TH Nicolson. 1963. Spores of mycorrhizal Endogone species extracted from soil by wet sieving and decanting. Transactions of the British Mycological Society 46: 235-244.
13. Graham, J; L Duncan & D Eissenstat. 1997. Carbohydrate allocation patterns in citrus genotypes as affected by phosphorus nutrition, mycorrhizal colonization and mycorrhizal dependency. New Phytologist 135: 335-343.
14. Hart, MM & RJ Reader. 2002. Taxonomic basis for variation in the colonization strategy of arbuscular mycorrhizal fungi. New Phytologist 153: 335-344.
15.INVAM. 2019. International Culture Collection of (Vesicular) Arbuscular Mycorrhizal Fungi. West Virginia University, Morgantown, West Virginia. URL: http://invam.wvu.edu/ the-fungi/species-descriptions (02/2019)
16. Jakobsen, I 1995. Transport of phosphorus and carbon in VA mycorrhizas. Mycorrhiza: Springer, 297-324.
17. Javot H, N Pumplin & MJ Harrison. 2007. Phosphate in the arbuscular mycorrhizal symbiosis: transport properties and regulatory roles. Plant, Cell and Environment 30(3): 310-322.
18. Jenkinson, D & D Powlson. 1976. The effects of biocidal treatments on metabolism in soil-I. Fumigation with chloroform. Soil Biology and Biochemistry 8: 167-177.
19. Kelly, R; DG Edwards; JP Thompson & RC Magarey. 2001. Responses of sugarcane, maize, and soybean to phosphorus and vesicular-arbuscular mycorrhizal fungi. Australian Journal of Agricultural Research 52: 731-743
20. Kough. J; V Gianinazzi-Pearson & S Gianinazzi. 1987. Depressed metabolic activity of vesicular arbuscular mycorrhizal fungi after fungicide applications. New Phytologist 106: 707-715.
21. Lendenmann, M; C Thonar; RL Barnard; Y Salmon; RA Werner; E Frossard & J Jansa. 2011. Symbiont identity matters: carbon and phosphorus fluxes between Medicago truncatula and different arbuscular mycorrhizal fungi. Mycorrhiza 21: 689-702.
22. Leyva, A; A Quintana & M Sanchez. 2008. EN: Rodriguez; J Cremata & JC Sanchez. 2008. Rapid and sensitive anthrone- sulfuric acid assay in microplate format to quantify carbohydrate in biopharmaceutical products: Method development and validation. Biologicals 36: 134-141.
23. Li AR; SE Smith, FA Smith & KY Guan. 2012. Inoculation with arbuscular mycorrhizal fungi.suppresses initiation of haustoria in the root hemiparasite Pedicularis tricolor. Annals of Botany 109(6):1075-80.
24. Maherali, H. 2014. Is there an association between root architecture and mycorrhizal growth response? New Phytologist 204: 192-200
25. Marschner, H. 1995. Functions of mineral nutrients: macronutrients. Mineral nutrition of higher plants 2nd Edition. Academic Press, NY: 299-312.
26. McGonigle, T; M Miller; D Evans; G Fairchild & J Swan. 1990. A new method which gives an objective measure of colonization of roots by vesicular-arbuscular mycorrhizal fungi. New Phytologist 115: 495-501.
27. Meghvansi, M; K Prasad; D Harwani & SK Mahna. 2008. Response of soybean cultivars toward inoculation with three arbuscular mycorrhizal fungi and Bradyrhizobium japonicum in the alluvial soil. European Journal of Soil Biology 44(3)
28. Müller A, B Ngwene, E Peiter & George E. 2017.Quantity and distribution of arbuscular mycorrhizal fungal storage organs within dead roots. Mycorrhiza 27(3): 201-210.
29. Murphy, J & JP Riley. 1962. A modified single solution method for the determination of phosphate in natural waters. Analytica Chimica Acta 27: 31-36.
30. Newman, E. 1966. A method of estimating the total length of root in a sample. Journal of applied Ecology 3: 139-145.
31. Nijjer, S; WE Rogers & E Siemann. 2010. The impacts of fertilization on mycorrhizal production and investment in Western Gulf Coast Grasslands. The American Midland Naturalist 163(1): 124-133.
32. Phillips, JM & DS Hayman. 1970. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Transactions British Mycological Society 55: 158-161.
33. Pieters, AJ; MJ Paul & DW Lawlor. 2001. Low sink demand limits photosynthesis under Pi deficiency. Journal of Experimental Botany 52: 1083-1091.
34. Plaxton, WC & MC Carswell. 1999. Metabolic aspects of the phosphate starvation response in plants. Plant responses to environmental stresses: from phytohormones to genome reorganization. Marcel Dekker, New York: 349-372.
35. Plenchette, C; J Fortin & V Furlan. 1983. Growth responses of several plant species to mycorrhizae in a soil of moderate P-fertility. Plant and Soil 70: 199-209.
36. Safir, GR; JS Boyer & JW Gerdemann. 1972. Nutrient Status and Mycorrhizal Enhancement of Water Transport in Soybean. Plant Physiology 49: 700-703.
37. Schalamuk, S; S Velazquez & M Cabello. 2013. Dynamics of arbuscular mycorrhizal fungi sporepopulations and their viability under contrasting tillage systems in wheat at different phenological stages. Biological Agriculture & Horticulture 29(1): 38-45.
38. Schenck, NC; JL Spain & E Sieverding. 1986. A new sporocarpic species of Acaulospora (Endogonaceae). Mycotaxon 25:111-117.
39. SchuBler, A & C Walker. 2010. The Glomeromycota. A species list with new families and new genera. The Royal Botanic Garden Kew, Botanische Staatssammlung Munich, and Oregon State University. Disponible en http://amf-phylogeny. com/Schuessler&Walker2010_Glomeromycota.pdf
40. Smith, SE & DJ Read. 2010. Mycorrhizal symbiosis: Academic press. Third Edition, 787 pp
41. Tinker, P; D Durall & M Jones. 1994. Carbon use efficiency in mycorrhizas theory and sample calculations. New Phytologist 128: 115-122.