BIOLOGÍA DEL SUELO
Impacto a largo plazo de la fertilización sobre la estructura y funcionalidad de la comunidad microbiana del suelo
Long-term impact of fertilization on the structure and functionality of microbial soil community
Jimena Ortiz1*; Valeria Soledad Faggioli1; Hugo Ghio2; Monica Fabiola Boccolini1; Juan Pablo Ioele1; Pablo Tamburrini3;
Fernando O. Garcia4; Vicente Gudelj1
1 Instituto Nacional de Tecnología Agropecuaria. Argentina
2 Asociación Argentina de Productores en Siembra directa (AAPRESID). Argentina
3 Nutrien Ag Solutions. Argentina
4 Facultad de Ciencias Agrarias (UNMdP), Balcarce, Argentina.
* Autor de contacto: ortiz.jimena@inta.gob.ar
Recibido: 20/12/2018
Recibido con revisiones: 25/11/2019
Aceptado: 03/12/2019
RESUMEN
Para un manejo sustentable no se deben desconocer los efectos de la fertilización sobre el suelo y sus procesos microbianos. El objetivo
de este trabajo fue evaluar el efecto acumulado de diferentes dosis de fertilización sobre las comunidades microbianas del suelo en dos
profundidades (0-5 cm y 5-10 cm). El trabajo se realizó sobre un ensayo de campo con aplicación incorporada de fertilizantes desde
1999. Las dosis de fertilización evaluadas fueron: testigo (T), dosis de productor (DP), dosis de reposición (DR) y dosis de reposición
con agregado de micronutrientes (DRM). Se midieron variables de estructura (DGGE), actividades enzimáticas de hidrólisis del diacetato
de fluoresceína, fosfatasa ácida, ureasa y arilsulfatasa, nitrógeno potencialmente mineralizable (NAN) y glomalinas. La fertilización
afectó diferencialmente las funciones microbiológicas en las dos profundidades. Los valores de ureasa fueron mayores en T a 0-5 cm.
Los valores de NAN fueron superiores en T y DP a 0-5 cm y en T a 5-10 cm. En cambio, fosfatasa y glomalinas predominaron en DR
y DRM. La acidez del suelo y volumen de rastrojo generados por la fertilización habrían ocasionado los elevados valores de fosfatasa
y glomalinas. La disminución de NAN en altas dosis de fertilización respondería al incremento de la mineralización generado por el
agregado de nutrientes (efecto "priming"). La estructura de la comunidad microbiana fue afectada por la fertilización en diferente medida
según la profundidad de muestreo. En 0-5 cm la riqueza y diversidad fueron similares entre tratamientos. En cambio, en 5-10
cm, ambos índices fueron drásticamente afectados por la aplicación de fertilizantes. El índice de diversidad de Shannon fue de 2,21 y
2,20 en T y DP; y 1,4 y 1,39 en DR y DRM. Sólo se hallaron correlaciones significativas entre la actividad enzimática y la comunidad
bacteriana en la profundidad 0-5 cm. El mantenimiento de la sustentabilidad de los agroecosistemas depende en gran medida del equilibrio
entre la estructura y las funciones biológicas provistas por los microorganismos del suelo. Esperamos que este aporte constituya
una herramienta más para tener en cuenta al momento de tomar decisiones sobre el manejo de fertilización a largo plazo en cultivos.
Palabras claves: Actividad enzimática, DGGE, nitrógeno potencialmente mineralizable, comunidad bacteriana.
ABSTRACT
To understand effects of fertilization on microbial communities and processes a long-term fertilization treatment was performed. Since
1999, a field experiment was conducted and variables of structure (DGGE), enzymatic activity (phosphatase, urease, arylsulfatase),
potentially mineralizable nitrogen (NAN) and glomalins were measured at two depths (0-5 cm and 5-10 cm). At both depths, fertilizer
rates affected microbiological functions of the biomass community differentially. Urease activity was higher for the Control treatment at
0-5 cm depth, while NAN activity was higher for the Control and the Farmer Rate treatment at 0-5 cm and also in the Control treatment
at 5-10 cm depth. Phosphatase and glomalin levels were higher for Reposition Rate treatment. Soil acidity and harvest residue volume
generated by fertilization could have caused high phosphatase and glomalins values. NAN decrease at higher fertilization rates could
have been caused by the mineralization increase generated by the nutrient addition ("priming" effect). Microbial community structure
was affected differently by fertilization according to sampling depth. At 0-5 cm depth, richness and evenness were similar between
treatments, while at 5-10 cm depth, both indexes were drastically affected by fertilizer application. Evenness was 2.21 and 2.20 for
Control and Farmer Rate treatment, and 1.4 and 1.39 for Reposition Rate treatment. Significant correlations were found between the
enzymatic activity and the microbial structure at 0-5 cm depth. The sustainability of agroecosystems depends on the balance between
the structure and the biological functions provided by soil microorganisms. We hope this study will be crop management decision tool.
Keywords: Enzymatic activity, DGGE, potentially mineralizable nitrogen, bacterial community.
INTRODUCCIÓN
El uso de fertilizantes es una de las prácticas
de manejo más importantes para suplir nutrientes
e incrementar el rendimiento de los cultivos
y la calidad del grano. En cada campaña, nitrógeno
(N), fósforo (P) y azufre (S) son aportados
para la producción de cereales y oleaginosas. Los
cultivos de mayor importancia económica en Argentina
son maíz, trigo y soja que ocupan 4,25;
3,7 y 20,7 mill ha, respectivamente, con una dosis
promedio de fertilizantes de 186; 131 y 46
kg ha-1 (Fertilizar, 2016).
Aunque la fertilización va destinada a los cultivos,
también incide sobre los organismos que
habitan el suelo debido a las alteraciones en las
propiedades del físico-químicas (Correa, 2016).
Al aplicar un fertilizante, la alteración inmediata
es el incremento en la disponibilidad de nutrientes,
pero a largo plazo la acidificación del
suelo es el principal efecto negativo causado por
la práctica de fertilización (Wallace, 1994). Una
revisión de 34 casos analizados demostró que
en 84% de los mismos la comunidad microbiana
fue sensible a la fertilización (Geisseler & Scott,
2014). Zhalnina et al., (2015) observaron que
los cambios en la composición, diversidad y biomasa
microbiana se debieron al pH del suelo.
En tanto que, a partir de un relevamiento a escala
global, Fierer (2017) realizó una jerarquización
de los factores bióticos y abióticos que influyen
sobre las comunidades bacterianas y halló que
el pH del suelo es el parámetro de mayor importancia.
Los microorganismos del suelo intervienen
en el ciclo de los nutrientes a través de la regulación
de los procesos de mineralización de materia
orgánica y mantenimiento de los stocks de nutrientes
en el suelo. Las técnicas moleculares han
permitido un gran avance en el estudio de la composición
de las comunidades microbianas (Van Elsas
et al., 2019). En tanto que las maneras más
habituales de cuantificar las funciones llevadas
a cabo por los microorganismos es través de la
actividad de enzimas tales como la fosfatasa, arilsulfatasa
y ureasa que intervienen en la mineralización
de P, S y N, respectivamente (Nannipieri
et al., 2003; Ferreras et al., 2009). Los nutrientes
retenidos en estructuras orgánicas representan
una medida de su grado de conservación dentro
del sistema (Hisrch, 2019). Por ejemplo, fracciones
del N orgánico pueden estimarse a través
del N potencialmente mineralizable (NAN) y en
estructuras proteicas del suelo, tales como las
denominadas "glomalinas" (Wright & Upadhyaya,
1999; Echeverría et al., 2000). Esta última
también se ha citado como un agente cementante
de agregados (Rillig, 2004). Un suelo estable
mantendrá una óptima diversidad biológica y un
equilibrio entre la conservación de recursos y la
mineralización.
El impacto de la fertilización sobre los microorganismos
depende del tipo de fertilizante, la dosis
y el método de aplicación (Soares Rosado et al.,
2019). Numerosos estudios tendientes a cuantificar
el efecto de prácticas agronómicas sobre
comunidades microbianas del suelo se realizaron
a una determinada profundidad en los primeros
centímetros de la superficie (Chakraborty et al.,
2011; Boccolini et al., 2016; Correa, 2016). Sin
embargo, la incorporación subsuperficial de fertilizantes
podría afectar a los microorganismos
que habitan en capas más cercanas al sitio de la
aplicación (Geisseler & Scott, 2014). El objetivo
de este trabajo fue evaluar el efecto acumulado
de diferentes dosis de fertilización sobre la composición
y funcionalidad de las comunidades microbianas
del suelo en dos profundidades (0-5
cm y 5-10 cm).
MATERIALES Y MÉTODOS
Descripción del ensayo y
diseño experimental
El estudio se realizó en un ensayo de fertilización
de larga duración iniciado en el año 1999
en Camilo Aldao, provincia de Córdoba (33° 11'
20,09'' S, 61° 58´ 49,34´´ O). El suelo del sitio
es un Argiudol Típico de textura franco limosa perteneciente
a la serie Hansen (INTA, 1985). El diseño
experimental fue de franjas de 6000 m2 para
cada tratamiento (30 m de ancho por 200 m de
largo). La rotación realizada fue maíz - trigo/soja.
Los tratamientos evaluados fueron: Testigo sin
fertilización (T) y tres situaciones de fertilización
con NPS: Dosis de productor (DP), Dosis de reposición
(DR) y Dosis de reposición con el agregado
de micronutrientes (Zn y B) (DRM). La dosis de productor fue 80 Kg ha-1 de N, 17 Kg ha-1 de P
y 15 Kg ha-1 S, para maíz, y 80 Kg ha-1 de N,
21 Kg ha-1 de P y 14 Kg ha-1 S, para trigo/soja.
La determinación de la dosis de reposición
se realizó en función de un rendimiento objetivo
definido para cada cultivo y los requerimientos
por tonelada de grano de cada uno de ellos,
utilizando el valor referenciado de Echeverría &
García (2014). En maíz se definió un rendimiento
objetivo de 12000 kg ha-1, por lo cual se aplicó
264 kg ha-1 de N; 48 kg ha-1 de P y 48 kg ha-1 de S en DR, mientras que en el tratamiento DRM
se aplicó además de la dosis anterior 0,24 kg ha-1 de B y 0,64 kg ha-1 de Zn. Para el trigo se definió
un rendimiento de 5000 kg ha-1 y se aplicó 150
kg ha-1 de N, 25 kg ha-1 de P y 25 kg ha-1 de S
para el tratamiento DR, mientras que en el tratamiento
DRM se aplicó además de la dosis anterior
0,125 kg ha-1 de B y 0,26 kg ha-1 de Zn. En soja
se definió un rendimiento de 3400 kg ha-1 y se
consideró que un 60% del N de la soja proviene
de la fijación biológica, según lo evaluado por
Salvagiotti et al. (2015), por lo cual la aplicación
de fertilizante en el tratamiento DR fue 102
kg ha-1 de N, 23,8 kg ha-1 de P y 15,3 kg ha-1 de S, mientras que en el tratamiento DRM se aplicó
además 0,085 Kg ha-1 de B y 0,20 Kg ha-1 de Zn.
La aplicación de los fertilizantes se realizó
anualmente en las mismas parcelas, según el tratamiento,
por debajo al costado de la semilla (N
y S) o en la línea de siembra (P).
El muestreo se realizó previo a la siembra del
cultivo estival en septiembre de 2015 (16 años
de duración del experimento). La toma de muestras
fue realizada teniendo en cuenta un área representativa
dentro de cada franja de 6000 m2.
Cada área fue dividida en tres subáreas (20x 100
m), a lo largo de las cuales se tomaron muestras
compuestas por 20 submuestras cada una,
a dos profundidades: 0-5 y 5-10 cm; de manera
de obtener pseudoréplicas para cada tratamiento,
ya que cada parcela representa un tratamiento
y por lo tanto no es posible obtener réplicas verdaderas
dadas las características del experimento.
Las muestras fueron tamizadas (malla de 2
mm), y una fracción de la muestra se conservó
a 4ºC hasta la determinación de la actividad microbiana
y otra porción se conservó a -20ºC para
la extracción del ADN genómico.
Determinaciones en suelo
El pH del suelo fue medido a una relación suelo
agua 1:2,5 (IRAM 29410, 1999). Las variables
microbiológicas medidas fueron: actividad enzimática
global por la hidrólisis de fluoresceína diacetato
(FDA) (Adam & Ducan, 2001), actividad
de fosfatasa ácida (Tabatabai & Bremner, 1969),
ureasa (Tabatabai & Bremner, 1972) y arilsulfatasa
(Tabatabai & Bremner., 1970), nitrógeno
anaeróbico potencialmente mineralizable (NAN)
(Echeverría et al., 2000) y proteínas fácilmente
extraíbles reactivas a Bradford, comúnmente denominadas
"glomalinas" (Wright & Upadhyaya,
1999).
La extracción de ADN se realizó a partir
de 0,25 g de suelo con kit comercial Power soil
(MO BIO Laboratories, Inc. Carlsbad, CA). Para
la amplificación del gen 16S ARNr se realizó
una PCR con el set de primers R534 y F341-GC
que codifican para la región variable V3 de 200
pb (Muyzer et al., 1994). Los productos PCR fueron
separados en electroforesis mediante la técnica
DGGE (Muyzer et al., 1993). Se prepararon
geles de poliacrilamida al 8% con un gradiente lineal
desnaturalizante de 40 a 60%. Las condiciones
de electroforesis fueron a 60 V durante 16 h
a 60°C. Los geles se tiñeron con GelRed en TAE
1X durante 45 min y se visualizaron bajo luz UV.
Los perfiles DGGE fueron digitalizados y analizados
con el software Gel Compare II (Applied
Maths). La posición y la intensidad de las bandas
fueron utilizadas para posteriores análisis estadísticos
y estimación de índices de diversidad Shannon-
Wiener (Shannon, 1948) y riqueza (Menhinick,
1964).
Análisis estadístico
Para el análisis estadístico de los datos microbiológicos
se utilizó el programa InfoStat (Di
Rienzo et al., 2017). Se aplicó un Modelo Lineal
Generalizado Mixto (MLGM) tomando como
efecto fijo los tratamientos de fertilización y las
profundidades, y como efectos aleatorios a las repeticiones
de campo. Cuando el p-valor del test fue p<0,05 se compararon las medias por el test
DGC con significancias del 5%. La comparación
en la composición de las comunidades se realizó
mediante análisis de permutaciones y múltiple
ANOVA (permanova). El gráfico de composición
de comunidades se realizó en base a un PCO
(Principal Coordinate Analysis) con el paquete
labsdv de R (R Development Core Team, 2018).
Se estimaron correlaciones lineales entre las variables
microbiológicas y las comunidades bacterianas
con la función envfit del paquete vegan del
software R, sólo se graficaron los vectores correlacionados
significativamente (p<0,05). También
se realizó el análisis de correlación de Pearson
entre el pH y la riqueza y diversidad de bacterias.
RESULTADOS Y DISCUSIÓN
Comportamiento del pH del suelo
Una de las consecuencias negativas ocasionadas
por la fertilización mineral es la disminución
del pH del suelo. En este estudio los valores
de pH fueron mayores en T respecto a los tratamientos
DP, DR y DRM, tanto para la profundidad
de 0-5 cm como para la profundidad de 5-10
cm. Hubo una disminución significativa del 10%
19%, y 20% del valor del pH entre T y los tratamientos
DP, DRM y DR, respectivamente, en la
profundidad de 0-5 cm (MGLM, p<0,05) (Tabla
1). Mientras que en la profundidad de 5-10 cm,
la disminución fue de 6%, 13%, y 16% entre T y
los tratamientos DP, DRM y DR, respectivamente
(MGLM, p<0,05) (Tabla 1). Estos resultados
concuerdan con estudios sobre ensayos de larga
duración con fertilización mineral (Liang et al.,
2014; Boccolini et al., 2016). Además, nuestra
investigación demuestra que la reducción
del pH se mantuvo y con la misma tendencia
en ambos estratos muestreados (i.e. 0-5 cm y
5-10 cm).
Comportamiento microbiológico del suelo
Funcionalidad de la comunidad microbiana
Las variables microbiológicas respondieron
de manera diferencial según profundidad y dosis
de fertilización (Tabla 1). La actividad enzimática
global medida a través de FDA no fue afectada
por las prácticas de fertilización, presentando los
mayores valores en el estrato superficial (MGLM,
p<0,05) (Tabla 1)). Esto responde a que a medida
que se aumenta la distancia desde la superficie
disminuye el número de microorganismos
y sus actividades enzimáticas (Frey, 2007).
Nuestros resultados coinciden con Morales et al.,
(2016), quienes, en un suelo Hapludalf Típico
en 0-10 cm de profundidad, luego de nueve años
de fertilización mineral no observaron efectos significativos
en la actividad de FDA. Mientras que Chakraborty et al., (2011) observaron mayor
actividad de FDA en los tratamientos con fertilización
mineral de NPK respecto al tratamiento
control sin fertilización luego de 37 años. La ausencia
de respuesta a la fertilización entre T y las
diferentes estrategias de fertilización evaluadas
en este estudio indica que la FDA es una variable
biológica estable frente al efecto acumulado de la
fertilización a largo plazo.
Tabla 1. Valores medios de pH del suelo, actividades enzimáticas (FDA, fosfatasa, arilsulfatasa, ureasa), nitrógeno potencialmente
mineralizable (NAN) y glomalinas en los diferentes tratamientos de fertilización a 0-5 cm y 5-10 cm de profundidad.
Table 1. Mean soil pH, enzymatic activity (FDA, phosphatase, arylsulfatase, urease), anaerobic nitrogen (NAN) and glomalin values
per fertilization treatment at 0-5 cm and 5-10 cm depth.
(*) Corresponde a compuestos proteicos reactivos a Bradford. Letras diferentes entre filas de una misma columna indican diferencias estadísticas significativas
según MLGM y test DGC nivel de significancia 5%.
Respecto a las variables microbiológicas que
respondieron a las dosis de fertilización, se hallaron
dos grupos, uno conformado por fosfatasa
y glomalina que respondieron con mayores valores
en los tratamientos de mayor fertilización (i.e.
DR y DRM), y un segundo grupo conformado por
ureasa y NAN que tuvieron mayores valores en los
tratamientos de nula a menor fertilización (i.e. T y
DP) (MGLM, p<0,05) (Tabla 1).
Para los primeros 5 cm, la actividad fosfatasa
y glomalina presentaron valores superiores en los
tratamientos DR y DRM. La glomalina, además,
fue mayor en el tratamiento DR en la profundidad
de 5-10 cm (MGLM, p<0,05) (Tabla 1). Las
glomalinas son sustancias compuestas por proteínas,
lípidos y materiales húmicos altamente
resistentes. Su presencia en el suelo ha sido vinculada
a mejoras en las propiedades físicas del
suelo y como una fuente de almacenamiento de N
y C de larga duración (Rillig et al., 2001). Aumentos
en los contenidos de glomalinas en altas
dosis de fertilización se han relacionado al aporte
de material vegetal (Jun et al., 2007), altos contenidos
de P del suelo (Wu et al., 2011) y siembra
directa (Dai et al., 2017). El mayor volumen
de material vegetal en los tratamientos de alta fertilización
podría explicar los mayores contenidos
de glomalinas en DR y DRM en relación con los
tratamientos T y DP a la profundidad de 0-5 cm.
Dick et al. (2000) observaron que la mayor
actividad de la fosfatasa ácida se registró en rangos
de pH de 5 a 5,5, mientras que por encima
de esos valores la enzima disminuyó drásticamente
en el suelo. En dicha investigación, el contenido
de P no afectó la actividad fosfatasa, es decir,
se observaron altos valores de fosfatasa en situaciones
de elevada oferta de P. En cambio, DeForest
et al. (2012) hallaron que el comportamiento
de la enzima fue dependiente de la biodisponibilidad
inicial de P, observando una disminución
de la actividad enzimática al agregarle P al suelo.
Nuestros resultados coinciden con lo hallado por
Dick et al. (2000), es decir, la actividad fosfatasa
ácida fue significativamente mayor en los
tratamientos con bajo pH (DR y DRM) (MGLM,
p<0,05) (Tabla 1). En un estudio realizado sobre
el mismo experimento, se observó que dichos tratamientos
presentaban los mayores valores de P
extractable, con niveles de P (mg kg-1) iguales
a 39,9 en DRM; 38,9 en DR; 8,5 en DP; 4,7
en T (Gudelj et al., 2017). Es decir que, en nuestra
investigación, la mayor biodisponibilidad de P
no inhibió la actividad enzimática tal como lo observó
DeForest et al. (2012). Sin embargo, son
necesarias más investigaciones tendientes a profundizar
sobre la interacción de la biodisponibilidad
de P y pH del suelo en ambientes de alta
disponibilidad de P para comprender las consecuencias
que los cambios en las propiedades del
suelo producen en las funciones de las fosfatasas
en el agroecosistema.
Las variables relacionadas al ciclo del N, ureasa
y NAN, mantuvieron una tendencia similar
de respuesta a los tratamientos de fertilización
en ambas profundidades (Tabla 1). En 0-5 cm de
profundidad, la actividad de la ureasa presentó
los mayores valores en T, seguido de los tratamientos
DP, DR y, por último, el tratamiento DRM
(MGLM, p<0,05) (Tabla 1). En 5-10 cm de profundidad,
los contenidos de ureasa en T se igualaron
a los contenidos del tratamiento DP, diferenciándose
de los tratamientos DRM y DR, los
cuales presentaron un contenido inferior (MGLM,
p< 0,05) (Tabla 1). De manera similar, la variable
NAN en 0-5 cm de profundidad fue superior
en los tratamientos T y DP respecto a DRM y DR.
En tanto que a 5-10 cm de profundidad, T registró
el mayor valor en comparación con el resto
de los tratamientos (MGLM, p<0,05) (Tabla 1).
Boccolini et al. (2016) también registró un menor
contenido de NAN en las situaciones con mayores
dosis de fertilizantes en un ensayo de fertilización
nitrogenada de larga duración. Los autores sugieren
que dicho comportamiento de NAN podría
deberse a un aumento en la velocidad de mineralización
de la materia orgánica particulada como
consecuencia de la aplicación de N (Galantini et al., 2008). Este efecto de la fertilización es denominado
"priming" y se menciona con frecuencia
asociado a la disminución de N potencialmente
mineralizable (NAN) debido a que la aplicación
de N aumenta el volumen de aportes de N orgánico
y, como consecuencia se reduce el pool de N
mineralizable del suelo (Kuzyakov et al., 2000).
Es probable, que este mecanismo también genere
una menor actividad de las enzimas relacionadas
al ciclo de N, tal como la ureasa. La disminución
de esta enzima en respuesta a la fertilización
nitrogenada ha sido citada por otros autores
quienes la proponen como un indicador del grado
de disturbio en los procesos biológicos debido a la
fertilización (Ajwa et al., 1999).
Las funciones relacionadas al ciclo del S fueron
evaluadas mediante la actividad de la enzima
arilsulfatasa (Tabla 1). En superficie (0-5 cm),
presentó mayores valores en los tratamientos T,
DP y DR; mientras que a la profundidad de 5-10
cm presentó mayores valores en los tratamientos
DR y DRM (MGLM, p<0,05) (Tabla 1). Similares
resultados fueron reportados por Prietzel et al.
(2001) quienes luego de una fertilización observaron
que la actividad de la enzima arilsulfatasa
en superficie (0-10 cm) era mayor en los tratamientos
control respecto al tratamiento fertilizado,
mientras que a mayor profundidad en ciertas épocas
del año la actividad de la enzima aumentaba
en los tratamientos fertilizados respecto al control
sin fertilizante. Por otro lado, Liang et al. (2014)
no observaron diferencias en la actividad de la
enzima tanto en superficie como en profundidad,
luego de 15 años de fertilización de reposición
en una rotación Trigo-Maíz.
Estructura de la comunidad microbiana
La estructura de la comunidad bacteriana,
estudiada mediante DGGE, fue afectada significativamente
por los tratamientos de fertilización
en diferente medida de acuerdo con la profundidad
de muestreo (Figura 1). En los primeros
0-5 cm se registraron valores de riqueza (número
de especies) y diversidad (índice de Shannon)
similares en todos los tratamientos de fertilización
(MLGM, p>0,05) (Figura 2a, Figura 3a).
En cambio, en la profundidad 5-10 cm, tanto
la riqueza como la diversidad fueron significativamente
menores en los tratamientos de alta fertilización
DR y DRM (MLGM, p<0,05) (Figura 2b,
Figura 3b). El efecto negativo de la fertilización
mineral a largo plazo sobre la comunidad bacteriana del suelo ha sido reportado por Marschner
et al. (2003). Del mismo modo, Ge et al. (2008)
observaron que la riqueza y diversidad de bacterias
disminuyó en tratamientos con fertilización
mineral nitrogenada en comparación con la aplicación
de enmiendas y fertilización sin N. Esta
disminución se asocia a que la fertilización disminuye
el pH del suelo y las bacterias se desarrollan
mejor en pH cercanos a la neutralidad (Fierer,
2017). En este estudio el efecto del pH del suelo
sobre la comunidad de bacterias fue evidenciado
por el análisis de correlación de Pearson.
Se observó una correlación altamente positiva
y significativa entre el pH y la riqueza (Pearson,
0-5cm: r2=0,27, p<0,05; 5-10cm: r2=0,90,
p<0,01), y el pH y la diversidad (Pearson,
0-5cm: r2=0,30, p<0,05; 5-10cm: r2=0,91,
p<0,01). Similares resultados fueron reportados
por Lauber et al. (2009) quienes luego de realizar
pirosecuenciación de 88 suelos, observaron
que la diversidad filogenética de las comunidades
bacterianas se correlacionó con el pH del suelo
(R2= 0,50), con picos de diversidad en suelos
con pH cercanos a la neutralidad.
Figura 1. Conglomerados según Dice y UPGMA en base a DGGE de amplicones 16S rRNA T: Testigo, DP: Dosis de productor,
DR: Dosis de reposición, DRM: DR + micronutrientes; (0-5) y (5-10) indican las profundidades (cm). I, II y III: Repeticiones de cada
tratamiento. Se presenta sombreado el cluster que se separó del resto de los tratamientos.
Figure 1. Conglomerates according to Dice and UPGMA based on DGGE of 16S rRNA amplicons. T: Control without fertilization,
DP: Farmer rate, DR: Replacement rate, DRM: DR + micronutrients; (0-5) and (5-10) indicate the depths (cm). I, II and III:
Repetitions per plot. The cluster that was separated from the rest of the treatments was shaded.
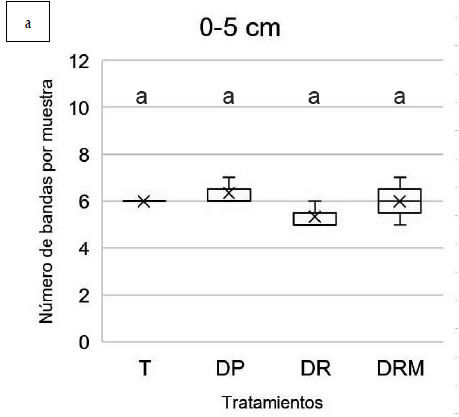
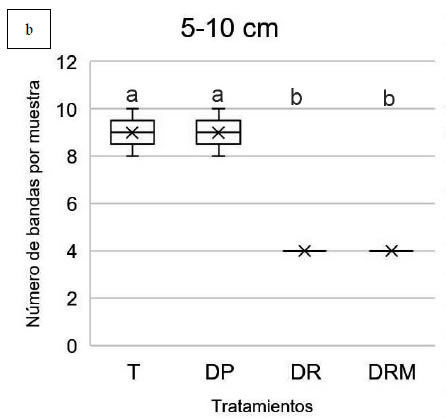
Figura 2. Riqueza de especies (número de bandas) obtenida mediante amplificación del gen 16S rRNA y DGGE a partir de muestras
de suelo con diferentes tratamientos de fertilización: T: control sin fertilización, DP: Dosis de productor, DR: Dosis de reposición,
DRM: Dosis de reposición más micronutrientes. A. profundidad 0-5 cm. B. Profundidad 5-10 cm. Letras diferentes indican
diferencias estadísticamente significativas entre tratamientos de la misma profundidad (MLGM, Test DGC 5%).
Figure 2. Species richness (number of bands) obtained by amplification of the 16S rRNA gene and DGGE from soil samples with
different fertilization plots: T: control without fertilization, DP: Farmer rate, DR: Replacement rate, DRM: Replacement rate +
micronutrients. A. Depth 0-5 cm. B. Depth 5-10 cm. Different letters indicate statistically significant differences between plots for the
same depth (MLGM, DGC Test 5%).
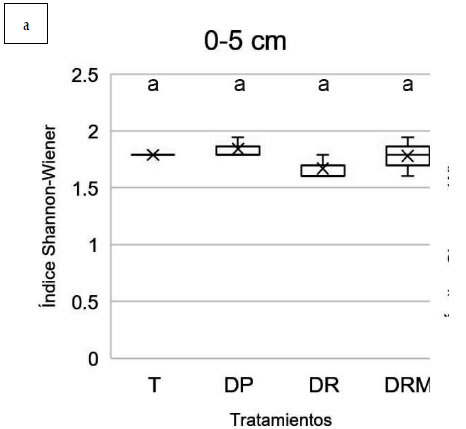
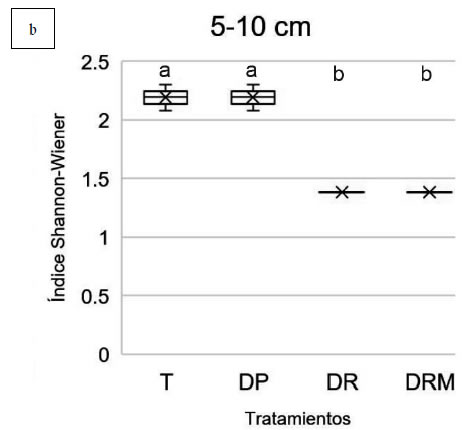
Figura 3. Diversidad de especies (índice Shannon-Wiener) obtenida mediante amplificación del gen 16S rRNA y DGGE a partir
de muestras de suelo con diferentes tratamientos de fertilización: T: control sin fertilización, DP: Dosis de productor, DR: Dosis
de reposición, DRM: Dosis de reposición más micronutrientes. A. profundidad 0-5 cm. B. Profundidad 5-10 cm. Letras diferentes
indican diferencias estadísticamente significativas entre tratamientos de la misma profundidad (MLGM, Test DGC 5%).
Figure 3. Species diversity (Shannon-Wiener index) obtained by amplification of the 16S rRNA gene and DGGE from soil samples with different
fertilization plots: T: control without fertilization, DP: Farmer rate, DR: Replacement rate, DRM: Replacement rate+ micronutrients. A. Depth
0-5 cm. B. Depth 5-10 cm. Different letters indicate statistically significant differences between plots of the same depth (MLGM, DGC Test 5%).
Se observaron diferencias estadísticamente
significativas en la composición de las comunidades
de 0-5 cm vs 5-10 cm (permanova,
R=0,52; p<0,01), y entre tratamientos de fertilización
(permanova, R=0,21; p<0,01). La relación
entre la composición de la comunidad microbiana,
el pH y las variables de funcionalidad
microbiana se representan en la Figura 4A y B).
Las comunidades bacterianas del suelo en T y DP
presentaron mayor similitud entre sí que con los
tratamientos de altas dosis de fertilización (i.e.
DR y DRM) para ambas profundidades (0-5 cm:
permanova, r=0,20; p<0,007; 5-10 cm: permanova,
r=0,43; p<0,001) (Figura 4A y B).
En los primeros 5 cm, las actividades enzimáticas,
glomalinas, pH y NAN se correlacionaron
con la composición de las comunidades microbianas
tal como se observa en la Figura 4A)
a través de los vectores cuya dirección y longitud
representan el sentido y significancia de la
correlación, respectivamente (envfit, p<0,05).
La comunidad bacteriana de los tratamientos
de menor fertilización (T y DP) correlacionó con
pH, NAN y actividad de ureasa (Figura 4A, envfit
p<0,05), mientras que ante mayores dosis
de fertilización (i.e. DR y DRM), correlacionó con
actividad de fosfatasa y contenido de glomalinas
(Figura 4A, envfit p<0,05). Podría inferirse que
frente a limitaciones nutricionales presentes en T
y DP, se incrementaron las funciones relacionadas
al ciclo del nitrógeno, el principal macronutriente
requerido por los cultivos. En las situaciones
de mayor fertilización, en cambio, las alteraciones
de las propiedades químicas del suelo, favorecieron
aquellos procesos que demandan bajos
valores de pH, como es el caso de las fosfatasas
ácidas. Finalmente, en la profundidad 5-10
cm, la composición de la comunidad bacteriana
solo correlacionó con pH (envfit, p<0,05) (Figura
4B). Los tratamientos que presentaron mayor
acidificación (DR y DRM) mantuvieron su efecto
sobre las comunidades microbianas en la capa
sub-superficial del suelo. Nuestros resultados
demuestran que las bacterias son sensibles a la
acidificación del suelo producto del uso prolongado
de fertilizantes y que los efectos negativos
se manifiestan tanto en los primeros cm como
en la capa sub-superficial de 5-10 cm. Sin embargo,
aunque el pH constituye el mejor predictor
de la composición de las comunidades bacterianas
del suelo (Fierer, 2017), no todas las especies
responden iguales. Es decir, mientras algunas
son muy sensibles a los cambios de pH, otras
son cosmopolitas y se adaptan a un gran rango
de condiciones (Delgado-Baquerizo et al., 2018).
Por ejemplo, Rousk et al. (2010) observaron predominio
de acidobacterias en pH más bajos y nitrosospira,
α-, β-, y δ-Proteobacteria en pH más
altos. Por su parte, Boccolini et al. (2016) observaron
que la diversidad de bacterias oxidantes
de amoniaco aumento en los sitios de mayor fertilización
que a su vez tuvieron una disminución
significativa en los valores de pH.
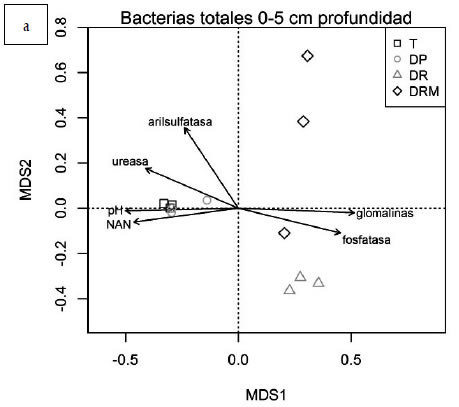

Figura 4. Análisis de composición de comunidades bacterianas (PCO) obtenidas mediante amplificación de gen 16S rRNA y DGGE
a partir de muestras de suelo con diferentes tratamientos de fertilización: T: testigo sin fertilización, DP: Dosis de productor,
DR: Dosis de reposición, DRM: Dosis de reposición más micronutrientes. A. Profundidad 0-5 cm. B. Profundidad 5-10 cm. Los
vectores representan correlaciones lineales estadísticamente significativas (p<0, 05) entre las comunidades bacterianas y actividad
enzimática, NAN, glomalinas y pH. La dirección del vector indica el sentido del gradiente y su longitud representa la significancia
estadística.
Figura 4. Analysis of composition of bacterial communities (PCO) obtained by amplification of 16S rRNA gene and DGGE from
soil samples with different fertilization treatments: T: control without fertilization, DP: Farmer rate, DR: Replacement rate,
DRM: Replacement rate + micronutrients. A. Depth 0-5 cm. B. Depth 5-10 cm. The vectors represent statistically significant linear
correlations (p <0,05) between bacterial communities and enzymatic activity, NAN and glomalin. The direction of the vector
indicates the direction of the gradient and its length represents the statistical significance.
CONCLUSIONES
Para los primeros 5 cm, la fertilización afectó
la estructura de la comunidad bacteriana observándose
cambios en la composición de las comunidades.
También afectó la funcionalidad, con
aumentos en las fosfatasas y glomalinas y disminución
de actividad ureasa y NAN ante incrementos
de las dosis de fertilización.
En la capa sub-superficial (5-10cm), en cambio,
la fertilización no sólo generó cambios en la
composición de la comunidad bacteriana del suelo
sino que también se observaron reducciones
significativas de la riqueza y diversidad frente
a dosis de reposición de nutrientes (DR y DRM).
En términos generales, aunque la funcionalidad
biológica fue menor, hubo respuesta a la fertilización
registrándose elevados valores de glomalinas
y arilsulfatasa en alta dosis de fertilización; y de
NAN en ausencia de fertilización.
Tales diferencias estuvieron asociadas a los
efectos de la fertilización sobre el pH del suelo
debido al historial de 16 años ininterrumpidos
de aplicación de fertilizantes.
AGRADECIMIENTOS
Este trabajo fue financiado por del Instituto
Nacional de Tecnología Agropecuaria (INTA) a través
de los proyectos PNCY0 1127032, PNCYO
1127033 y CORDO 1262101; y también por
el Instituto Internacional de Nutrición de Plantas
(IPNI), la Asociación Argentina de Productores
en Siembra directa (AAPRESID) y Nutrien Ag Solutions.
BIBLIOGRAFÍA
1. Adam, G & H Duncan. 2001. Development of a sensitive and
rapid method for the measurement of total microbial activity
using fluorescein diacetate (FDA) in a range of soils.
Soil Biol Biochem 33(7-8): 943-951.
2. Ajwa, HA; C Dell & CW Rice. 1999. Changes in enzyme
activities and microbial biomass of tallgrass prairie soil
as related to burning and nitrogen fertilization. Soil Biol
Biochem 31(5): 769-777.
3. Boccolini, MF; LA Basile; CR Cazorla; C Galarza; B Conde &
ELM Figuerola. 2016. Impacto de la aplicación prolongada
de urea sobre bacterias nitritantes de un Argiudol
típico, Argentina. Ciencia del suelo 34 (1): 21-31.
4. Chakraborty, A; K Chakrabarti; A Chakraborty & S Ghosh.
2011. Effect of long-term fertilizers and manure application
on microbial biomass and microbial activity of a tropical
agricultural soil. Biology and Fertility of Soils 47(2):
227-233.
5. Correa, 2016. La fertilización y las comunidades microbianas
indígenas de los suelos. En: AACS (ed.). Sustentabilidad
de agrosistemas y el uso de fertilizantes. . Vol. 1.
1era edn Pp. 141-167.
6. Dai, J; J Hu; A Zhu & X Lin. 2017. No‐tillage with halfamount
residue retention enhances microbial functional
diversity, enzyme activity and glomalin‐related soil
protein content within soil aggregates. Soil Use Manag
33(1): 153-162.
7. DeForest, JL; KA Smemo; DJ Burke; HL Elliott & JC Becker.
2012. Soil microbial responses to elevated phosphorus
and pH in acidic temperate deciduous forests. Biogeochemistry
109 (1-3): 189-202.
8. Delgado-Baquerizo, M; AM Oliverio; TE Brewer; A Benavent-
González; DJ Eldridge; RD Bardgett & N Fierer. 2018.
Aglobal atlas of the dominant bacteria found in soil.
Science 359 (6373): 320-325.
9. Di Rienzo, JA; F Casanoves; MG Balzarini; L Gonzalez;
M Tablada & CW Robledo. 2017. InfoStat versión 2017.
Grupo InfoStat, FCA, Universidad Nacional de Córdoba,
Argentina. En: http://www.infostat.com.ar.
10. Dick, RP. 1992. A review: long-term effects of agricultural
systems on soil biochemical and microbial parameters.
Agriculture, Ecosystems & Environment 40(1-4): 25-36.
11. Dick, WA; L Cheng & P Wang. 2000. Soil acid and alkaline
phosphatase activity as pH adjustment indicators.Soil
Biol Biochem 32(13): 1915-1919.
12. Echeverría, HE & FO García. 2014. Fertilidad de Suelos
y Fertilización de Cultivos. Ediciones INTA. 904 pp.
13. Echeverría, HE; N San Martin & R Bergonzi. 2000. Métodos
rápidos de estimación del nitrógeno potencialmente
mineralizable en suelos. Ciencia del Suelo 18(1): 9-16.
14. Ferreras, L; S Toresani; B Bonel; E Fernández; S Bacigaluppo;
V Faggioli & C Beltrán. 2009. Parámetros químicos
y biológicos como indicadores de calidad del suelo en diferentes
manejos. Ciencia del suelo, 27(3): 103-114.
15. Fertilizar. 2016. Consumo de Fertilizante de todos los cultivos.
En: http://www.fertilizar.org.ar/.
16. Fierer, N. 2017. Embracing the unknown: disentangling the
complexities of the soil microbiome. Nature Reviews Microbiology,
15(10): 579-590.
17. Frey, SD. 2007. Spatial distribution of soil organisms. En:
EA Paul. (ed.). Soil microbiology, Ecology and Biochemistry.
Vol. 1. 3ra edn Pp 283-300. Academic Press.
Oxford. 552 pp.
18. Galantini, JA; J Iglesias; M Landriscini; L Suñer & G Minoldo.
2008. Calidad y dinámica de las fracciones orgánicas
en sistemas naturales y cultivados. En: Galantini, JA. Vol.
1. 1ra edn Pp. 71-95. Universidad Nacional del Sur.
19. Ge, Y; JB Zhang; LM Zhang; M Yang & JZ He. 2008. Longterm
Fertilization Regimes Affect Bacterial Community
Structure and Diversity of an Agricultural Soil in Northern
China. J Soils Sediments 8 (1): 43-50.
20. Geisseler, D & KM Scott. 2014. Long-term effects of mineral
fertilizers on soil microorganisms-A review. Soil Biol Biochem
75: 54-63.
21. Gudelj V; H Ghio; O Gudelj; C Lorenzon; MB Conde; JP Ioele;
C Galarza; P Vallone; P Tamburrini & F García. 2017.
Evaluación de reposición de nutrientes en experimentos
de larga duración del Sudeste de Córdoba. En: Salvagiotti,
F; H Krüger & G Studdert. Ensayos de Larga Duración
en Argentina: Un aporte al logro de Sistemas Agrícolas
Sustentables. Vol. 1. 1ra edn Pp. 115-144. Ediciones
INTA. 386 pp.
22. Hirsch, PR. 2019. Microorganisms cycling soil nutrients.
Capítulo 11. Pp. 179-195. In: van Elsas, JD; JT Trevors;
JK Soares Rosado & P Nannipieri. (Eds). Modern
soil microbiology. Third Edition. CRc Press. Boca Raton.
USA. 472 pp.
23. INTA (Instituto Nacional de Tecnología Agropecuaria). 1985.
Carta de suelos de la República Argentina. Hoja 3363 -
23. Corral de Bustos.
24. IRAM (Instituto Argentino de Normalización y Certificación)
1999. Norma 29 410. Determinación del pH.
25. Jun, N; ZH Jian-Min; W Huo-Yan; C Xiao-Qin & DU Chang-
Wen. 2007. Effect of Long-Term Rice Straw Return
on Soil Glomalin, Carbon and Nitrogen. Pedosph 17(3):
295-302.
26. Kuzyakov, Y; JK Friedel & K Stahr. 2000. Review of mechanisms
and quantification of priming effects. Soil Biol Biochem
32(11-12): 1485-1498.
27. Lauber, CL; M Hamady; R Knight & N Fierer. 2009. Pyrosequencing-
based assessment of soil pH as a predictor
of soil bacterial community structure at the continental
scale. Appl Environ Microbiol 75(15): 5111-5120.
28. Liang, Q; H Chen; Y Gong; H Yang; M Fan & Y Kuzyakov.
2014. Effects of 15 years of manure and mineral fertilizers
on enzyme activities in particle-size fractions in a
North China Plain soil. European Journal of Soil Biology,
60: 112-119
29. Marschner, P; E Kandeler & B Marschner. 2003. Structure
and function of the soil microbial community in a longterm
fertilizer experiment. Soil Biol Biochem 35(3): 453-
461.
30. Menhinick, EF. 1964. A Comparison of some Species-Individuals
Diversity Indices Applied to Samples of Field Insects.
Ecology 45 (4): 859-861.
31. Morales, D; MM Vargas; MPD Oliveira; BL Taffe; J Comin;
CR Soares & P Lovato. 2016. Response of soil microbiota to nine-year application of swine manure and urea.
Ciência Rural 46(2): 260-266.
32. Muyzer, G; EC De Waal & AG Uitterlinden. 1993. Profiling
of complex microbial populations by DGGE analysis
of polymerase chain reaction-amplified genes coding for
16S rRNA. Appl env micr 59(3): 695-700.
33. Nannipieri, P; J Ascher; MT Ceccherini; L Landi; G Pietramellara
& G Renella 2003. Microbial diversity and soil
functions. Eur. J. Soil Sci. 54, 655-670.
34. R Development Core Team. 2018. R: A language and environment
for statistical computing.
35. Prietzel, J. 2001. Arylsulfatase activities in soils of the
Black Forest/Germany-seasonal variation and effect
of (NH4) 2SO4 fertilization. Soil Biology and Biochemistry,
33(10): 1317-1328.
36. Rillig, MC. 2004. Arbuscular mycorrhizae, glomalin, and soil
aggregation. Canadian Journal of Soil Science, 84(4):
355-363.
37. Rillig, MC; SF Wright; KA Nichols; WF Schmidt & MS Torn.
2001. Large contribution of arbuscular mycorrhizal fungi
to soil carbon pools in tropical forest soils. Plant Soil
233(2): 167-177.
38. Rousk, J; E Bååth; PC Brookes; CL Lauber; C Lozupone;
JG Caporaso; R Knight & N Fierer. 2010. Soil bacterial
and fungal communities across a pH gradient in an arable
soil. The ISME journal 4(10): 1340-1351.
39. Salvagiotti, F; DJ Collino; A Perticari; C Piccinetti; G Ovando;
S Urquiaga & RW Racca. 2015. El aporte de la fijación
biológica de nitrógeno en el cultivo de soja en Argentina.
Informaciones Agronómicas de Hispanoamérica.
40. Shannon, CE. 1948. A mathematical theory of communication.
Bell System Technical Journal, 27, 379-423.
41. Soares Rosado, A; P Nannipieri & JD van Elsas. 2019. Management
strategies for soil used for cultivation, including
modulation of the soil microbiome. Pp 431-459. En: van
Elsas, JD; JT Trevors; JK Soares Rosado & P Nannipieri
(Eds). Modern soil microbiology. Third Edition. CRc
Press. Boca Raton. USA. 472 pp.
42. Tabatabai MA & JM Bremner.1969. Phosphatase activity. In:
K Alef & P Nannipieri. Methods in Applied Soil Microbiology
and Biochemistry. Vol. 1. 1ra edn Pp. 335-344.
Academic Press Inc. London. 860 pp.
43. Tabatabai MA & JM Bremner. 1972. Urease activity. En:
K Alef & P Nannipieri. Methods in Applied Soil Microbiology
and Biochemistry. Vol. 1. 1ra edn Pp. 316-320.
Academic Press Inc. London. 860 pp.
44. Tabatabai MA & JM Bremner. 1970. Arylsulfatase activity.
En: K Alef & P Nannipieri. Methods in Applied Soil Microbiology
and Biochemistry. Vol. 1. 1ra edn Pp. 364-365.
Academic Press Inc. London. 860 pp.
45. van Elsas, JD; JT Trevors; JK Soares Rosado & Nannipieri,
P. 2019. Modern soil microbiology. Third Edition. CRc
Press. Boca Raton. USA. 472 pp.
46. Wallace, A. 1994. Soil acidification from use of too much
fertilizer. Communications in Soil Science and Plant
Analysis, 25(1-2): 87-92.
47. Wright, SF & A Upadhyaya. 1999. Quantification of arbuscular
mycorrhizal fungi activity by the glomalin concentration
on hyphal traps. Mycorrhiza 8(5): 283-285.
48. Wu, F; M Dong; Y Liu; X Ma; L An; JP Young & H Feng. 2011.
Effects of long-term fertilization on AM fungal community
structure and Glomalin-related soil protein in the Loess
Plateau of China. Plant soil 342(1-2): 233-247.
49. Zhalnina, K; R Dias; PD de Quadros; A Davis-Richardson;
FA Camargo; IM Clark & Triplett, E. W. 2015. Soil
pH determines microbial diversity and composition
in the park grass experiment. Microbial ecology, 69(2):
395-406.





