Table 1. Applied amount of active ingredient (p.a.) of pesticides analyzed in rotation (R) and soybean monoculture (S) accumulated after 9 years.

CONTAMINACIÓN DEL SUELO Y CALIDAD DEL MEDIO AMBIENTE
Plaguicidas retenidos en el suelo y perdidos por escurrimiento en dos secuencias de cultivo bajo siembra directa
Pesticides retained in soil and lost by runoff in two crop sequences under no tillage
Ana Clara Caprile*1; María Carolina Sasal2; María Rosa Repetti3; Adrián Enrique Andriulo3
1 INTA EEA Pergamino
2 INTA EEA Paraná
3 PRINARC FIQ - UNL
* Autor de contacto: caprile.ana@inta.gob.ar
Recibido: 5/10/2018
Recibido con revisiones: 8/5/2019
Aceptado: 21/5/2019
RESUMEN
Los plaguicidas utilizados en la agricultura, además de cumplir con su función objetivo de control, se distribuyen en el ambiente
y pueden ser retenidos, degradados y/o transformados, o también transportados fuera del lugar de su aplicación. El objetivo del
trabajo fue comparar la presencia de plaguicidas en el agua de escurrimientos con lluvia simulada y en el perfil de suelo hasta un
metro de profundidad en dos secuencias de cultivos bajo siembra directa. El estudio forma parte de un ensayo de comparación de
sistemas de producción de cultivos de larga duración implementado en la serie de suelo Pergamino pura. Se compararon dos tratamientos:
secuencia maíz-soja-trigo/soja (R) y monocultivo de soja (S). En agua y suelo se determinaron los siguientes compuestos:
azoxistrobina, ciproconazol, carbendazim, cipermetrina, clorpirifós, 2,4-D, atrazina, glifosato, ácido aminometilfosfónico (AMPA)
y metsulfuron-metil. Las cantidades perdidas por escurrimiento fueron muy pequeñas en relación a las cantidades retenidas en el
suelo. R retuvo más plaguicidas en el perfil del suelo (azoxistrobina, clorpirifós, 2,4-D, glifosato) y a su vez tuvo menor cantidad de
detecciones en el agua de escurrimiento (carbendazim, AMPA y metsulfuron-metil) que S. Cuando se relacionó la cantidad perdida
y retenida con respecto a la cantidad aplicada (acumulada luego de 9 años), nuevamente, en R, algunos plaguicidas quedaron
más retenidos (azoxistrobina, clorpirifós, 2,4-D) y otros se perdieron menos en agua de escurrimiento (ciproconazol, atrazina).
El mantenimiento de la calidad de suelo a través de una elevada biomasa aérea de residuos sobre la superficie y de un sistema
poroso relativamente estable acompañado de una reserva razonable de carbono orgánico en el espesor 0-5 cm promueve procesos
biofísicos de degradación que disminuyen el intercambio de plaguicidas entre el agroecosistema y su entorno.
Palabras clave: herbicidas, insecticidas, fungicidas, lluvia simulada
ABSTRACT
Pesticides, after being applied, in addition to fulfilling their objective function, are distributed in the environment and they can be retained,
degraded and/or transformed, or also transported from the application place. Crop sequence intensification degree can affect
its fate in the environment. The objective of the work was to compare the presence of pesticides in the runoff water with simulated
rain and in the soil profile up to one-meter depth, in two crop sequences under no tillage. The study is part of an essay comparison
of long-term crop production systems implemented in the Pergamino pure series. Two treatments were used: corn-soybean-wheat/
soybean sequence (R) and soybean monoculture (S). In water and soil, the following compounds were determined: azoxystrobin, ciproconazol,
carbendazim, cypermethrin, chlorpyrifos, 2,4-D, atrazine, glyphosate, aminomethylphosphonic acid (AMPA) and metsulfuron-
methyl. The amounts lost by runoff were very small in relation to the amounts retained in the soil. R retained more pesticides
in the soil profile (azoxystrobin, chlorpyrifos, 2,4-D, glyphosate) and it had lower detections in the runoff water (carbendazim, AMPA
and metsulfuron-methyl) than S. When it was related the amount lost and retained with respect to the amount applied, accumulated
after 9 years, again, in R, some pesticides were more retained (azoxystrobin, chlorpyrifos, 2,4-D) and others were lost less in the
runoff (ciproconazole, atrazine) than in S. The maintenance of the soil quality through an important mulch on the surface and a
relatively stable porous system accompanied by a reasonable reserve of organic carbon in the thickness 0-5 cm promotes biophysical
degradation processes that reduce the exchange of pesticides between the agroecosystem and its environment.
Keywords: herbicides, insecticides, fungicides, simulated rain
INTRODUCCIÓN
Una de las funciones del suelo es la de actuar como bioreactor, transformando, reteniendo y degradando sustancias y, además, filtrando y purificando el agua que drena (Comerford, 2013). Los cambios en los sistemas de laboreo y diferentes prácticas de manejo agrícola alteran las propiedades del suelo y modifican su funcionamiento. Analizar el destino ambiental de los plaguicidas bajo diferentes prácticas de manejo puede ayudarnos a comprender en qué grado esta función de bioreactor se sostiene en el tiempo.
Los primeros centímetros de suelo en los sistemas bajo siembra directa (SD) presentan estratificación y acumulación de residuos orgánicos. Su deposición continua y la falta de labranzas ayudan a la creación y al mantenimiento de la macroporosidad por actividad biológica. La existencia de bioporos estables y continuos ayudan a incrementar la infiltración y la disponibilidad de agua (Gil & Garay, 2001). Sin embargo, las condiciones de humedad de suelo cambian con la secuencia de cultivos y modifican el movimiento de agua y solutos en la matriz del suelo.
Las secuencias más intensificadas, generalmente, presentan una mayor cobertura de residuos con consecuentes menores temperatura y pH edáficos respecto a secuencias simplificadas con propensión al monocultivo de soja (Irizar, 2010; Milesi Delaye et al., 2014). Reddy & Locke (1998) registraron incremento en el riesgo de lixiviación de plaguicidas con variaciones de pH de 6 a 7,5 debido a que su solubilidad en agua se multiplicó por 16. El pH y el contenido de carbono orgánico del suelo (COS) son dos parámetros muy importantes en la retención de plaguicidas (Aparicio et al., 2015). El incremento en COS y sus fracciones de reciclado rápido mejoran la estabilidad del espacio poroso. Sin embargo, aumentos de COS pueden retardar el uso de los residuos de plaguicidas como fuente de carbono por los microorganismos (Locke & Harper, 1991).
Por otro lado, la secuencia de cultivos implementada condiciona la dinámica de plagas y, por lo tanto, la de los productos aplicados para su control químico (Fischer & Connor, 2018). En monocultivo de soja bajo SD, se genera una tendencia al incremento de las malezas por la falta de competencia y destrucción mecánica y, por aumento del banco de semillas en la superficie, que conlleva el aumento en el uso de los herbicidas. Glifosato, 2,4-D, metsulfuron-metil y atrazina se encuentran entre los 10 herbicidas más usados en la región (Principiano & Acciaresi, 2018). Los insecticidas más utilizados son cipermetrina y clorpirifós para control de lepidópteros, mientras para los funguicidas la mayoría de las aplicaciones son en base a mezclas de estrobirulinas más triazoles (RETAA, 2013).
Cuando los plaguicidas alcanzan la superficie, una fracción es interceptada/retenida por los cultivos o rastrojos. Cuanto mayor es la acumulación de residuos, es mayor su intercepción, y este proceso, es más importante en compuestos apolares o de baja polaridad (Alletto et al., 2010).
El escurrimiento superficial es la principal fuente de la contaminación de los cuerpos de agua. Los plaguicidas que tienen alta sorción se transportan unidos a los sedimentos de erosión; en cambio, los de alta solubilidad, se movilizan disueltos en el agua. Las lluvias son el principal factor que controla las tasas de escurrimiento, la erosión y la pérdida de plaguicidas. La cantidad de residuos vegetales y su naturaleza influyen en la rugosidad, la cual disminuye el escurrimiento. Además, en la pampa ondulada, se encontró que la SD combinada con monocultivo de soja promueven la formación de estructuras laminares que disminuyen la infiltración y aumentan el escurrimiento (Sasal et al., 2017).
El conocimiento específico de los procesos de disipación de plaguicidas en cada uno de los ambientes al cual se incorpora, es esencial para proporcionar herramientas de manejo agronómico tendientes a reducir el impacto ambiental de su uso. Por ello, es importante conocer el efecto de diferentes rotaciones de cultivo bajo SD sobre estos procesos, en las condiciones edafoclimáticas de la pampa ondulada. Se hipotetiza que la rotación de cultivos disminuye la pérdida de plaguicidas por escurrimiento y aumenta su retención dentro del suelo debido a una mejora en las propiedades edáficas con respecto al monocultivo. Los objetivos del presente trabajo fueron comparar en dos secuencias de cultivos contrastantes bajo SD: a) algunas propiedades físicas, químicas y biológicas del suelo, b) la presencia de plaguicidas en escurrimientos de lluvia simulada de elevada intensidad y c) la presencia de plaguicidas en el perfil de suelo hasta un metro de profundidad, luego de 9 campañas agrícolas.
MATERIALES Y MÉTODOS
El estudio se llevó a cabo en un ensayo de comparación de sistemas de producción agrícola iniciado en 2006 en la EEA Pergamino. El mismo se encuentra ubicado sobre la serie de suelo Pergamino pura, ocupando la loma plana (pendiente <0,5%). El suelo es un Argiudol típico, familia fina ilítica térmica (INTA, 1972). Se analizaron dos tratamientos bajo SD: a) secuencia de cultivos soja-trigo/soja-maíz (R) y b) monocultivo de soja (S). En el primer tratamiento, se recurrió al criterio de reposición para la recomendación de la fertilización con N, P y S y el umbral de daño para el control de plagas. En el segundo, no se utilizaron fertilizantes y los tratamientos con plaguicidas fueron hechos sin seguir umbrales de daño. Los muestreos de suelo y las simulaciones de lluvia se realizaron luego de 9 campañas agrícolas, en abril del 2015. Primero se muestreó el suelo y luego se realizaron las simulaciones de lluvia.
El diseño del ensayo es de bloques completos aleatorizados con 3 repeticiones. Cada unidad experimental tiene un tamaño de 18,7 x 80 m. En cada repetición se tomaron dos submuestras.
Muestreo de suelo
Se dividió el perfil de suelo hasta el metro de profundidad en 6 espesores (0-5, 5-20, 20- 30, 30-57, 57-82 y 82-100 cm), de acuerdo a descripción de horizontes del perfil típico de la serie en la carta de suelo y confirmado en muestreos previos. Para el muestro de los horizontes de suelos hasta los 30 cm de profundidad se utilizó pala. Por debajo de 30 cm se realizó con barreno helicoidal. Entre extracciones, se procedió a la limpieza con agua y posteriormente con alcohol para evitar contaminar las muestras con plaguicidas de diferentes espesores.
Se determinaron las siguientes propiedades edáficas:
-En el espesor 0-5 cm se realizaron determinaciones para la construcción de la curva de capacidad de retención de agua (ISO/FDIS 11274, 1998). La distribución de tamaño de poros fue calculada usando la relación entre el contenido de agua del suelo y el potencial mátrico (Hillel, 1980). Se sacaron muestras no disturbadas en cilindros (5 cm alto y 5 cm diámetro) en dirección vertical al perfil de suelo. Estas se saturaron al vacío durante 24 horas para minimizar la ruptura estructural, y, posteriormente, se llevaron al potencial matricial -1, -5 y -20 kPa, utilizando mesas de tensión con una columna de agua colgante (Bezerra de Oliveira, 1968). La retención de agua edáfica fue expresada como el contenido volumétrico de agua usando la densidad aparente para la conversión de los contenidos de agua gravimétrica a volumétrica. Los poros del suelo fueron clasificados como: microporos (<15 μm diámetro), mesoporos (15-60 μm) y macroporos (60-300 y >300 μm).
-En los espesores de 0-5 y 5-20 cm se determinó: carbono orgánico particulado (COP) según Cambardella & Elliot modificado (1992); índice de estabilidad de los agregados (IEA) según Douglas & Goss modificado (1982); nitrógeno total (NOS) según método de Kjeldahl (Nelson & Sommers, 1996); fósforo total (PT) por digestión ácida y colorimetría del ácido ascórbico (Sommers & Nelson, 1972); azufre total (ST) por Tabatabai (1982); carbono de la biomasa microbiana (CBM) por fumigación-extracción (Vance et al.,1987); carbono respirado (CRESP) según Jenkinson & Powlson (1976); actividad enzimática global (FDA) por hidrólisis del diacetato de fluoresceína (Schnürer y Rosswall, 1982); nitrógeno potencialmente mineralizable (NAN) según Bremner (1965) y Keeney (1982); coeficiente metabólico (qCO2), calculado como el cociente entre CRESP y CBM; densidad aparente máxima (DAPm) por Prueba Proctor, Proctor (1933); compactación relativa (CR) calculada como el cociente entre DAP y DAPm. Los porcentajes de COS y NOS de los espesores 0-5 y 5-20 cm se transformaron en reservas de COS y NOS (mCOS y mNOS), multiplicando las concentraciones por la profundidad y por la densidad aparente.
-En los espesores 0-5, 5-20 y 20-30 cm se determinó: densidad aparente (DAP) por el método del cilindro (Burke et al., 1986); fósforo extraíble (Pext) por Bray y Kurtz Nº1 (1945); y azufre de sulfatos (S-SO4) por turbidimetría en cloruro de bario (Johnson et al., 1987).
-En todos los espesores del perfil se determinó: COS (Walkley & Black, 1934), pH y conductividad eléctrica (CE) ambos en agua, por potenciometría y en la relación suelo:agua, 1:2,5.
Simulaciones de lluvia
Se realizaron simulaciones de lluvia para recolectar agua de escurrimiento y sedimentos. Éstas se efectuaron utilizando un simulador de lluvia de 50 cm de lado (Irurtia & Mon, 1994) con intensidades de lluvia elevada (60 mm ha-1) y durante una hora. Los registros de lluvia caída y escurrimiento se midieron cada 5 minutos. El simulador presenta una abertura en uno de sus laterales, para recoger el agua de escurrimiento en un recipiente graduado. De esta manera, teniendo en cuenta la cantidad de lluvia aplicada y el volumen de agua escurrida para un mismo intervalo de tiempo (5 minutos), se puede determinar la lámina de agua infiltrada en las distintas etapas del ensayo, como también estimar la tasa de infiltración y sus cambios en función del tiempo transcurrido. Las muestras fueron almacenadas en bidones de polietileno, previamente lavados con ácido nítrico 1:1 y enjuagados con agua deionizada, inmediatamente transportados al laboratorio y almacenados a 4 ºC hasta su análisis. Se determinó, al momento de la simulación, la biomasa aérea en base seca (kg ha-1). En las muestras de agua utilizadas para las simulaciones se determinó pH (potenciométrico) y CE (conductimétrico), nitrato y fósforo disuelto total (PDT), citados en APHA-AWWA-WPCF (1989). Se calculó la infiltración acumulada (Ia), la infiltración básica (Ib), el volumen de agua escurrida (Vol esc) y el coeficiente de escurrimiento (Coef esc).
El agua utilizada para las simulaciones se extrajo de una perforación de la EEA INTA Pergamino con valores de: pH = 8,3, CE = 0,98 dS m-1, nitrato= 10,7 mg L-1 y PDT= 0,2 mg L-1. Además, en la misma se detectó atrazina, ciproconazol, 2,4-D y glifosato por debajo de sus respectivos límites de cuantificación. Los sedimentos fueron obtenidos por filtración del agua escurrida, secados a 40ºC, y posteriormente pesados. Las masas recolectadas no resultaron en la cantidad suficiente para la determinación de plaguicidas.
Tabla 1. Cantidad aplicada de principio activo (p.a.) de los
plaguicidas analizados en la rotación (R) y el monocultivo de
soja (S) acumulada luego de 9 años.
Table 1. Applied amount of active ingredient (p.a.) of
pesticides analyzed in rotation (R) and soybean monoculture
(S) accumulated after 9 years.

Plaguicidas
Se calculó la cantidad total de principio activo (p.a.) de los plaguicidas analizados para cada tratamiento, acumulada luego de 9 años de aplicación (Tabla 1). Éstos fueron seleccionados para su determinación teniendo en cuenta los que se hubieran aplicado en los dos tratamientos y con reiterada frecuencia de uso. En todas las muestras recolectadas (suelo y agua) se determinaron los siguientes plaguicidas: azoxistrobina, ciproconazol, carbendazim, cipermetrina, clorpirifós, 2,4 D, atrazina, glifosato, AMPA y metsulfuron- metil. Estas fueron analizadas en el laboratorio PRINARC (Facultad de Ingeniería Química de la Universidad Nacional del Litoral). Las determinaciones de glifosato y AMPA se realizaron siguiendo la metodología descripta por Demonte et al. (2018). El resto de los plaguicidas se analizó según el procedimiento descripto por Regaldo et al. (2017). Los extractos obtenidos se analizaron empleando Cromatografía Líquida acoplada a espectrometría de masa en tándem (UHPLCMS/ MS) y Cromatografía de gases acoplada a espectrometría de masa en tándem (GC-MS/ MS). La metodología completa, en todos los casos, fue validada siguiendo el documento guía de la Comunidad Europea SANTE/11945 (EC, 2015).
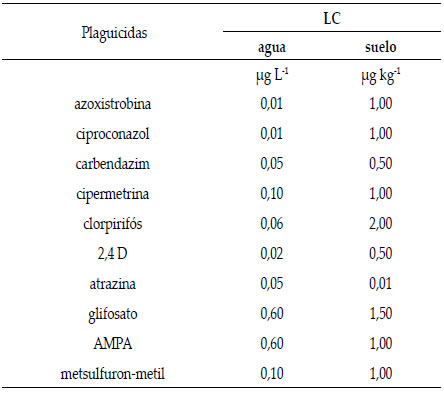
Se calculó la cantidad acumulada de cada principio activo en todo el perfil al momento de muestreo, utilizando la sumatoria de los productos de la concentración del plaguicida por la masa de cada espesor de suelo. Para los espesores 30-57, 57-82 y 82-100 se tomaron los valores de densidad aparente comúnmente reportados para la serie de suelo, 1,39, 1,35 y 1,29 g cm-3, respectivamente. La cantidad de agua perdida por escurrimiento se realizó mediante el producto entre la concentración medida y el volumen escurrido. Los límites de cuantificación (LC) de los plaguicidas analizados se presentan en la Tabla 2. En los casos de detección de plaguicidas por debajo del límite de cuantificación, para poder calcular las cantidades perdidas/retenidas, se utilizó un valor medio entre LC y límite de detección (LD), considerando que LD= LC/3,3, SANTE/11945 (EC, 2015).
Tabla 2. Límite de cuantificación (LC) de los plaguicidas
analizados en suelo y agua.
Table 2. Limit of quantification (LC) of pesticides analyzed in
soil and water.
Análisis estadístico
Para analizar las diferencias entre los dos tratamientos sobre las concentraciones y cantidades de plaguicidas se utilizaron modelos lineales mixtos, los cuales permiten tener en cuenta los casos en que los residuos muestran heterogeneidad de varianza. Cuando no se cumplió el supuesto de normalidad se utilizó la transformación logarítmica. Los test de comparaciones múltiples se realizaron mediante la prueba LSD de Fisher (p<0,10). Se realizaron correlaciones simples entre las cantidades de plaguicida en agua y suelo a 0-5 y 0-100 cm y las propiedades y variables medidas en agua y suelo. Cuando no hubo detección en una muestra analizada, no se utilizó el dato para el cálculo de medidas estadísticas. Se utilizó Infostat como programa estadístico (Di Rienzo et al., 2013).
RESULTADOS
Efecto de la secuencia de cultivos
La biomasa aérea al momento del muestreo de suelo y de las simulaciones de lluvia presentó diferencias significativas entre los dos tratamientos, 9813 y 4280 kg ha-1, para R y S, respectivamente. La mayoría de las diferencias en las propiedades del suelo entre secuencias de cultivos se encontró principalmente en el espesor 0-5 cm (Tabla 3). En R, a 0-5 cm, las propiedades edáficas H, DAP, DAPm, microporosidad, IEA y MCOS, CE, Pext y S-SO4, CRESP, qCO2 y FDA fueron mayores que en S. Y, al contrario, porosidad total, macroporosidad, pH y NAN fueron menores. Nuevamente en R, pero a 5-20 cm, NOS, mNOS y FDA fueron mayores que en S.
Plaguicidas en el agua de escurrimiento
Como puede observarse en la Tabla 4, en R hubo 2 simulaciones que todavía no habían iniciado el escurrimiento una hora después del comienzo de las simulaciones. En R se observó una mayor Ia, menor Vol esc y menor Coef esc que en S. La elevada variabilidad observada en los datos recolectados de Ib no permitió que se encontraran diferencias estadísticas entre secuencias de cultivos.
Tabla 3. Propiedades físicas, químicas y biológicas de suelo en rotación (R) y monocultivo de soja (S) bajo siembra directa luego de 9 años.
Table 3. Physical, chemical and biological properties of soil in rotation (R) and soybean monoculture (S) under no tillage after 9 years.
R: rotación de cultivos; S: monocultivo de soja; DAP: densidad aparente; DAPm: densidad aparente máxima; CR: compactación relativa; IEA: índice de
estabilidad de agregados; macro >300: macroporos mayores a 300 μm; macro 300-60:macroporos entre 300 y 60 μm; meso 60-30: mesoporos entre 60 y 30
μm; meso 30-15: mesoporos entre 30 y 15 μm; micro <15:microporos menores a 15 μm; CE:conductividad eléctrica; COS: carbono orgánico del suelo; COP:
carbono orgánico particulado del suelo; mCOS: masa carbono orgánico del suelo; mCOP: masa carbono orgánico particulado del suelo; NOS: nitrógeno
orgánico de suelo; mNOS: masa nitrógeno orgánico de suelo; PT: fósforo total; Pext: fósforo extractable; ST: azufre total; S-SO4: azufre de sulfato; CRESP:
carbono respirado; CBM: carbono de la biomasa microbiana; qCO2:coeficiente metabólico; NAN: potencial de mineralización de nitrógeno; FDA: actividad
enzimática global.*letras diferentes indican diferencias entre tratamientos en el mismo espesor de suelo (p<0,10)
R: crop rotation; S: soybean monoculture; DAP: bulk density; DAPm: maximum bulk density; CR: relative compaction; IEA: aggregate stability index;
macro> 300: macropores greater than 300 μm; macro 300-60: macropores between 300 and 60 μm; 60-30 meso: mesopores between 60 and 30 μm; meso 30-15:
mesopores between 30 and 15 μm; micro <15: micropores less than 15 μm; CE: electrical conductivity; COS: soil organic carbon; COP: soil particulate organic
carbon; mCOS: soil organic carbon mass; mCOP: particulate organic carbon mass of the soil; NOS: soil organic nitrogen; mNOS: soil organic nitrogen mass;
PT: total phosphorus; Pext: extractable phosphorus; ST: total sulfur; S-SO4: sulfate sulfur; CRESP: breathed carbon; CBM: microbial biomass carbon; qCO2:
metabolic coefficient; NAN: nitrogen mineralization potential; FDA: global enzyme activity. * Different letters indicate differences between treatments in the
same soil thickness (p <0.10)
Tabla 4. Características de la infiltración y el escurrimiento
luego de la simulación de lluvia en rotación (R) y monocultivo
de soja (S).
Table 4. Characteristics of infiltration and runoff after rain
simulation in rotation (R) and soybean monoculture (S).
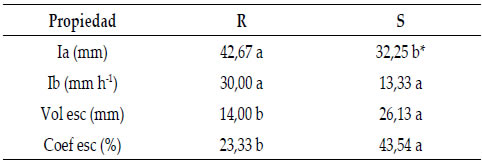
Ia: infiltración acumulada; Ib: infiltración básica; Vol esc: volumen
escurrido; Coef esc: Coeficiente de escurrimiento. *letras diferentes indican
diferencias entre tratamientos (p<0,10).
Ia: accumulated infiltration; Ib: basic infiltration; Vol esc: drained volume;
Coef esc: Runoff coefficient. * different letters indicate differences between
treatments (p <0.10)
La falta de escurrimiento en dos simulaciones de R elevó la variabilidad en las detecciones de plaguicidas (Tabla 5). Aun así, en general, hubo menor detección de plaguicidas en R. Se detectaron 7 y 9 moléculas sobre las 10 moléculas analizadas, en R y S, respectivamente. La azoxistrobina no se detectó en ningún tratamiento; tampoco la cipermetrina y el AMPA en R. Para ciproconazol, en R se encontraron menores concentraciones y cantidades perdidas en el escurrimiento y también, para atrazina menor concentración y una tendencia a menor cantidad perdida por escurrimiento (p<0.12) (Tabla 5). En los plaguicidas restantes, las cantidades medias escurridas en S tendieron a ser iguales o mayores que en R, aunque no se pudo aplicar el análisis estadístico para comparar las dos secuencias de cultivos en los casos de carbendazim, cipermetrina, clorpirifós, AMPA y metsulfuron metil.
Tabla 5. Plaguicidas en el agua de escurrimiento. Detecciones, concentraciones y cantidades perdidas en rotación
(R) y monocultivo de soja (S) bajo siembra directa.
Table 5. Pesticides in runoff water. Detections, concentrations and quantities lost in rotation (R) and soybean
monoculture (S) under no tillage.

ND: no detectado; <LC: detección bajo el límite de cuantificación. *letras diferentes indican diferencias entre tratamientos (p<0,10).
ND: not detected; <LC: detection under the quantification limit. * different letters indicate differences between treatments (p <0.10)
Plaguicidas en el perfil de suelo
Los funguicidas analizados sólo fueron detectados en los primeros 5 cm del perfil (Tabla 6). La azoxistrobina se encontró en mayor concentración en R que en S, no pudiéndose realizar el análisis estadístico de los fungicidas restantes por falta de detecciones. La cipermetrina solo fue detectada en una muestra de las dos secuencias de cultivos. El clorpirifós presentó varias detecciones y pocas cuantificaciones en todo el perfil, en las dos secuencias de cultivos. El 2,4-D fue cuantificado en todo el perfil, en los dos tratamientos, pero sin diferencias de concentración entre ellos debido a la elevada variabilidad interna. La atrazina también se cuantificó en todo el perfil pero tuvo diferencia entre tratamientos solamente en el espesor 0-5 cm a favor de R. El glifosato fue detectado en todo el perfil pero con pocas cuantificaciones; en cambio, su metabolito AMPA, se cuantificó con mayores concentraciones, sobre todo en el espesor 0-5 cm, no detectándose diferencias de concentración tanto en los espesores 0-5 como 5-20 cm. El metsulfuron metil no fue detectado en ninguna de las muestras obtenidas (datos no mostrados).
Las cantidades de plaguicidas acumuladas en el primer metro del perfil, para azoxistrobina, clorpirifós, 2,4-D y glifosato fueron mayores en R que en S (Figura 1). No existieron diferencias significativas entre secuencias de cultivos para atrazina y AMPA. Los restantes plaguicidas analizados no contaron con análisis estadístico por falta de un número suficiente de detecciones o por su no detección.
Tabla 6. Número de detecciones y concentraciones medias de los plaguicidas analizados en cada espesor del perfil de suelo hasta
el metro de profundidad en rotación (R) y monocultivo de soja (S) bajo siembra directa.
Table 6. Number of detections and average concentrations of pesticides analyzed in each soil profile thickness up to one meter
deep in rotation (R) and soybean monoculture (S) under no tillage.
ND: no detectado; <LC: detección bajo el límite de cuantificación. *letras diferentes indican diferencias entre tratamientos en el mismo espesor de suelo (p<0,10).
ND: not detected; <LC: detection under the quantification limit. * different letters indicate differences between treatments in the same soil thickness (p <0.10)
ND: no detectado. Letras diferentes entre barras indican diferencias entre tratamientos (p<0,10).
ND: not detected. Different letters between bars indicate differences between treatments (p <0.10).
Figura 1. Cantidad de plaguicidas presentes en el perfil de suelo hasta el metro de profundidad en
rotación (R) y monocultivo de soja (S), luego de 9 años bajo siembra directa.
Figure 1. Amount of pesticides present in soil profile up to one meter deep in rotation (R) and soybean
monoculture (S), after 9 years under no tillage.
Relaciones con cantidades aplicadas
En agua de escurrimiento, en R, ciproconazol y atrazina se perdieron relativamente 20 y 13 % menos que en S, respectivamente. No hubo diferencias entre tratamientos para 2,4 D y glifosato+AMPA y en el resto de los plaguicidas no se pudo realizar la comparación estadística (Figura 2a). Los porcentajes retenidos en el suelo en R fueron 2,2, 2,8 y 2,6 veces mayor para azoxistrobina, clorpirifós y 2,4 D que en S, respectivamente (Figura 2b). En cambio, la atrazina tuvo un comportamiento inverso: R retuvo la mitad que S. Teniendo en cuenta lo aplicado, para glifosato+AMPA no hubo diferencias y el resto de los plaguicidas no se pudo comparar estadísticamente.
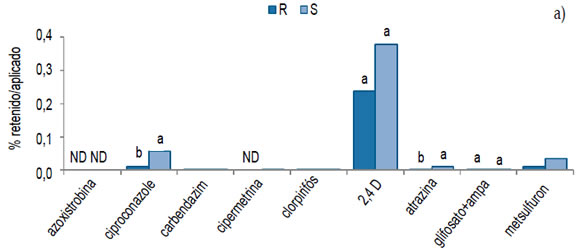

ND: no detectado. Letras diferentes entre barras indican diferencias entre tratamientos (p<0,10).
ND: not detected. Different letters between bars indicate differences between treatments (p <0.10)
Figura 2. Relación porcentual entre perdido en agua/aplicado (a) y retenido en suelo/aplicado (b) en
rotación (R) y en monocultivo (S) luego de 9 años bajo siembra directa.
Figure 2. Percentage ratio between lost in water/applied (a) and retained in soil/applied (b) in rotation
(R) and in soybean monoculture (S) after 9 years under no tillage.
DISCUSIÓN
Efecto de la secuencia de cultivos En general, las secuencias de cultivos impactaron significativamente sobre los atributos físicos, químicos y biológicos del suelo, particularmente cerca de la superficie del suelo, en la forma esperada. En R, los elevados aportes anuales de biomasa como retorno de cultivos se tradujeron en relativamente elevados valores medios de biomasa aérea de residuos sobre la superficie del suelo y de la humedad a 0-5 cm en el momento del muestreo (Milesi Delaye et al., 2013). Aunque en R el suelo tuvo mayor DAP (menor porosidad total), menor proporción de macroporos y mayor de microporos, la CR indicó la no existencia de suelo compactado, dado que se encontró por debajo de 0,9, umbral para indicar compactación (Carter et al., 1990). En general, no se observaron diferencias de porosidad total entre R y S (Sasal et al., 2010). En este caso, pudo estar asociado a la presión neumática bajo condiciones húmedas y/o a suelo húmedo en el momento de la cosecha de maíz, en marzo de 2015. Además, el valor medio de IEA mostró la formación de un sistema poroso moderadamente estable que conduce a una mayor infiltración y menor volumen escurrido. También hubo algunos cambios esperados en el espesor 5-20 cm.
El mayor aporte de biomasa en R, alimentado por la presencia del sistema radical de las gramíneas, condujo a un incremento en las mCOS y de mNOS y de NOS (en 5-20 cm). Esto está de acuerdo con la observación de varios autores sobre los efectos de la intensificación de cultivos, en el sentido del aumento del número de cultivos por año (Irizar et al., 2015). El manejo de la fertilidad en R provocó un descenso del pH y un aumento de la CE, la cual, si bien llegó a aumentar hasta los 20 cm de profundidad, no se considera limitante para el normal desarrollo de los cultivos. A su vez, la fertilización continuada permitió que se observaran mayores concentraciones de formas minerales de P y S, como Pext y S-SO4. Las propiedades biológicas fueron mayores en la rotación como se esperaría de un sistema con mayor aporte de carbono y nutrientes (Tiemann et al., 2015; D'Acunto et al., 2018). La mayor actividad enzimática microbiana, conjuntamente con un mayor coeficiente metabólico encontrados en R, indicaron una más elevada biodiversidad bajo una oferta más variada de calidades de sustrato. Si bien el menor contenido de NAN en R es un resultado no esperado (Martínez et al., 2014), la acidificación del suelo provocada por la fertilización podría estar ayudando a la generación de condiciones para desacelerar la degradación (menor concentración de NAN) a través de la disminución del pH (Divito et al., 2011).
Las variables analizadas en las simulaciones de lluvia en cada tratamiento tuvieron valores que concuerdan con lo presentado por Darder (2018). Sasal et al. (2010), analizando resultados de escurrimiento reportaron que las menores pérdidas de agua por escorrentía no estaban relacionadas directamente con la cantidad de rastrojo en superficie por los distintos cultivos, sino que este proceso estaba condicionado por el tiempo de ocupación de la vegetación viva. De esta manera, los largos barbechos invernales favorecen la generación de escurrimiento respecto a aquellas situaciones con cultivos en desarrollo durante todo el año. Distintos estudios demuestran la importancia de la vegetación como agente biológico protector del suelo, disminuyendo la erosión debido a que disipa la energía de gota de lluvia, retarda la velocidad del escurrimiento y aumenta la permeabilidad del suelo (Ruan et al., 2001).
Plaguicidas en el escurrimiento y el perfil del suelo
La no detección de azoxistrobina en agua de escurrimiento, se puede deber a su baja solubilidad, su corta vida media en agua y su alto Koc que le otorgan reducida movilidad (PPDB, 2018). Sin embargo, esta molécula se detectó en agua y en peces (Schreiner et al., 2016; Brodeur et al., 2017). En suelo, la mayor concentración hallada en los primeros 5 cm, en R, puede deberse a la mayor cantidad aplicada en este tratamiento (Tabla 1). Cuando se realizaron correlaciones entre las variables edáficas y este plaguicida, hubo correlaciones con el 60 % de las variables a 0-5 cm (biomasa aérea sobre el suelo, r=0,57; Ia, r=0,67; Ib, r=0,61; Vol esc, r=-0,72; Coef esc, r=-0,72; Humedad, r=0,55; DAP, r=0,85; CR, r=0,83; pH, r=-0,73; mCOS, r=0,68; mNOS, r=0,49; S-SO4, r=0,79 y qCO2, r=0,51). Esto está explicando que el manejo de suelo actúa significativamente sobre su retención: el aumento de la intensificación de cultivos bajo SD se traduce en un retardo del movimiento descendente de este plaguicida.
El ciproconazol se cuantificó en el 100% de las muestras en el agua de escurrimiento. Esto puede deberse a que su solubilidad es moderada y su persistencia en suelo es alta; es moderadamente móvil en suelo y tiene alta posibilidad de lixiviación (PPDB, 2018). Varios autores analizaron su presencia en medios acuosos y no lo detectaron (Herrero-Hernández et al., 2013). Las cantidades perdidas por escurrimiento se correlacionaron con el 65 % de las variables utilizadas y pusieron en evidencia el significativo efecto del manejo sobre dicha pérdida: cuando hubo menor biomasa aérea sobre el suelo (r=-0,69), menor ingreso de agua (r=-0,75), la superficie del suelo estaba relativamente más seca (r=-0,57) y más porosa (r=0,67), menor mNOS (r=-0,69), menor concentración de S-SO4 (r=-0,76), menor qCO2 (r=-0,68) y mayor pH (r=0,70) y NAN (r=0,52), aumentó la cantidad perdida del fungicida. Todas estas propiedades demuestran que en S las pérdidas fueron mayores. En relación a la cantidad aplicada (en el escurrimiento se perdió 5 veces más en S). En cambio, la cantidad retenida en el suelo, sólo pudo cuantificarse en los primeros 5 cm, una vez en S y 5 veces en R. Por un lado, esto estuvo bien relacionado con los resultados de las correlaciones (mayor retención del fungicida en el espesor 0-5 cm con mayor biomasa aérea (r=0,77), mayor contenido y masa de COS (r=0,59 y 0,55, respectivamente), suelo con menor compactación máxima (r=-0,58), menor pH (r=-0,52), mayor S-SO4 (r=0,78) y actividad enzimática en el mismo espesor (r=0,55). Y por otro, que su falta de presencia en suelo se podría deber a las características de la molécula (moderada movilidad y alta posibilidad de lixiviación). Además, la cantidad aplicada de este principio activo fue mayor en R (Tabla 1). Su retención con respecto a la cantidad aplicada, en R, fue 16 veces mayor que en S en el espesor 0-5 cm. Por otro lado, se encontraron correlaciones positivas entre la cantidad retenida en suelo de ciproconazol y la biomasa aérea (r=0,77), COS (r=0,59) y mCOS (r=0,55), todas variables que fueron mayores en R. La correlación negativa entre la cantidad retenida en suelo y el pH (r=-0,52), explicó el mayor número de detecciones en R, la cual tuvo un pH más bajo. La disipación de ciproconazol tiende a ser más rápida en suelos alcalinos que en ácidos (Buerge et al., 2006).
La baja detección de carbendazim puede deberse a su baja solubilidad, moderada persistencia en suelo y a que se degrada más rápidamente en agua (PPDB, 2018); por ello, hubo baja cuantificación en ésta. Las bajas detecciones en agua de este compuesto fueron reportados por Reemtsma et al. (2013) y analizados pero no detectados por Herrero-Hernández et al. (2013).
La cipermetrina sólo fue detectada en una muestra en agua y en una muestra de suelo, en S, en diferentes bloques del tratamiento. Esto pudo deberse a su baja solubilidad en agua; por lo tanto, a su hidrofobicidad. Como es un plaguicida no polar y se adsorbe fácilmente en la superficie del suelo, allí se fija (PPDB, 2018). De acuerdo con Kaufman et al. (1981), muy poco insecticida se movería a través del perfil del suelo. Sin embargo, este compuesto es frecuentemente detectado (Marino & Ronco, 2005). En el presente trabajo, la cantidad aplicada fue mayor en S (Tabla 1), pero su última aplicación fue bastante antigua en los dos tratamientos.
El clorpirifós fue detectado siempre bajo el límite de cuantificación en agua de escurrimiento en una muestra de cada tratamiento. Su baja solubilidad y corta vida media en agua podrían ser las causas (PPDB, 2018). Sin embargo, ha sido detectado en agua y sedimento (Marino & Ronco, 2005). En el suelo, se lo encontró principalmente en el espesor 0-5 cm y en varias muestras en profundidad y con cuantificaciones sólo en R. Este compuesto es altamente persistente en suelo (Chai et al., 2013) y moderadamente móvil, lo que le otorga un alto potencial para lixiviar; por esta razón, se lo puede encontrar en profundidad. Cuando se calculó la cantidad retenida en todo el perfil, en R fue 2,7 veces mayor que en S, aunque la cantidad aplicada en los 9 años fueron similares en ambos tratamientos (Tabla 1). Esta diferencia en la retención puede explicarse por la mayor sorción que tiene este insecticida en los sustratos orgánicos, lo que retrasa su mineralización (Gebremariam et al., 2012).
El 2,4-D se cuantificó en el 100% de las muestras de agua; ello se debió a su alta solubilidad en este medio (PPDB, 2018). Hubo una tendencia a perder más cantidad por escurrimiento en S. Esto sucedió porque la infiltración fue menor en este tratamiento y, por ende, el volumen de escurrimiento resultó mayor. También, porque las concentraciones tendieron a ser mayores. La cantidad aplicada fue ligeramente mayor en S (Tabla 1). A pesar de su baja persistencia y su baja posibilidad de lixiviación (PPDB, 2018), en el suelo se encontró distribuido en todo el perfil de ambos tratamientos y siempre fue cuantificado. La cantidad retenida en el perfil del suelo en R fue 2,5 veces mayor que en S. Esto también estuvo de acuerdo con la mayor infiltración y el menor pH que tuvo R, que condujo a un mayor ingreso de agua en el perfil con arrastre de 2,4- D en profundidad, ya que la adsorción de éste aumenta fuertemente con la disminución del pH del suelo y no es dependiente de COS (Barriuso et al., 1992). También, debido a su alta solubilidad y a la poca adsorción que tiene en el suelo, resulta móvil. Y a pesar de su baja persistencia, se lo siguió encontrando luego de que pasaran varios meses de su última aplicación. Sin embargo, el 2,4-D y su metabolito primario 2,4- DCP pueden permanecer en suelos agrícolas por largos períodos de tiempo debido a su uso intensivo (Aparicio et al., 2015). En este ensayo existen antecedentes de su aplicación antes de su inicio en 2006. Respecto a la degradación de 2,4-D, Merini et al., (2007) observaron, bajo condiciones experimentales, que los suelos de la pampa húmeda, sometidos a prácticas agrícolas intensivas y con historial previo de uso de fenoxi herbicidas, muestran una mayor capacidad de degradación del 2,4-D cuando existe uso intensivo.
La atrazina en agua se cuantificó en todas las muestras, a pesar de tener moderada solubilidad. Por su moderada vida media y su valor de Koc (PPDB, 2018), la frecuencia de detección en agua resultó alta. La concentración en S fue mayor que en R. Pero la cantidad perdida no difirió, a pesar de haber diferencia de volumen escurrido entre tratamientos. Harman et al., (2004) mostraron que la SD tiene un efectividad marginal para el control de la pérdida de atrazina en el escurrimiento. La existencia de menor biomasa aérea, menor Ia, menor DAP y CR, menor mCOS, y menores CRESP y qCO2 (poco sustrato para degradar fracciones activas) en S podrían explicar gran parte de estos resultados. Este herbicida es frecuentemente encontrado en cuerpos de agua (Vonberg et al., 2014; De Gerónimo et al., 2014). Uno de los motivos es que su uso fue generalizado durante décadas y, además, existen antecedentes de aplicaciones previas al inicio del ensayo.
La atrazina tiene alta probabilidad de lixiviación y moderada persistencia, y, por esto, se lo cuantificó en casi todas las muestras de suelo y en todos los espesores. Se ha comprobado su transporte en profundidad (Montoya et al., 2006). Las cantidades retenidas en los dos manejos fueron similares a pesar que la cantidad aplicada fuera 2 veces mayor en R (Tabla 1). Esto hizo que en relación a la cantidad total aplicada, la cantidad retenida en R resultara la mitad de la correspondiente a S. El mayor stock de C (mCOS) en R debería haber permitido mayor retención que en S, pero ocurrió lo contrario. En R, podría existir un proceso adicional de degradación, denominado bioestimulación. En suelos con antecedentes de uso frecuente de atrazina, existen microorganismos que están adaptados para producir una mayor degradación del producto (Hang et al., 2003). Éstos utilizan el N del anillo triazínico de la molécula para su crecimiento. Por otro lado, en S, por ser leguminosa, como se mencionó en la introducción, al existir más NAN que en R, habría una menor degradación de atrazina, dado que los microorganismos dispondrían de una fuente importante de N mineral.
Si bien tanto el glifosato como el AMPA tienen alta solubilidad en agua, hubo pocas detecciones y cuantificaciones en agua de escurrimiento en los dos tratamientos. La cantidad aplicada de glifosato fue 1,4 veces mayor en S (Tabla 1). A pesar de esto, no se encontraron diferencias entre manejos en agua de escurrimiento. Rampoldi et al. (2014) encontraron que la adsorción de glifosato era mayor en mezclas de rastrojo de maíz con suelo que en mezclas de rastrojo de soja con suelo, indicando que había un acoplamiento entre tipo de rastrojo y suelo, asociado a la secuencia de cultivos. Este resultado estaría apoyando parcialmente el resultado del presente trabajo. La menor actividad biológica bajo rastrojo de soja, la baja estabilidad de agregados y el aumento de pH ayudarían a perder más AMPA.
Tanto glifosato como AMPA se detectaron en todo el perfil, a pesar de que estos dos compuestos tienen baja probabilidad de lixiviación debido a su alta adsorción en suelo (Vereecken, 2005). A diferencia de lo que ocurrió con glifosato, el AMPA se cuantificó con elevadas concentraciones en 0-5 cm. Este último tiene alta persistencia en suelo, por ello se puede acumular (Simonsen et al., 2008). Por otro lado, AMPA presenta mayor movilidad que su producto parental (Kjær et al., 2005) y sumando el flujo preferencial presente en el suelo, existe la posibilidad de encontrar una mayor cantidad de este metabolito retenido en profundidad. El aumento de Pext en R puede indicar menor competencia por los sitios de adsorción (Mamy & Barriuso, 2007); la mayor actividad biológica existente en R puede haber favorecido la transformación a AMPA, con la consecuente disminución de su retención con respecto a S.
El metsulfuron-metil fue encontrado solamente en agua de escurrimiento y con pocas detecciones. Esto es esperable debido a la baja cantidad aplicada y a su baja persistencia en suelo. Además, su dinámica de sorción-desorción también lo pone disponible para su transporte (Azcárate el at., 2015). Debido a su alta solubilidad y débil adsorción en suelo, es móvil y puede ser transportado por los flujos de agua (Zanini et al., 2009). Es así que se lo detecta frecuentemente en agua superficial en cuencas de nuestro país (De Gerónimo et al., 2014).
En general, en R, el agua de escurrimiento tuvo un número menor de detecciones de plaguicidas mientras que el suelo retuvo a algunos de ellos más que en S (Tabla 5 y 6). Las cantidades perdidas por escurrimiento fueron muy pequeñas en relación a la cantidad de plaguicida aplicado (Figura 2 a). Esto puede deberse a la posición en el paisaje ocupada por la serie de suelo, con una pendiente < 0.5% y también a que varios compuestos analizados son no polares e hidrofóbicos (azoxistrobina, carbendazim, clorpirifós, cipermetrina), lo que significa que no son muy solubles en agua y tiendan a ser expulsados del agua hacia los suelos (Alletto et al., 2010). La detección de trazas de algunos plaguicidas en el agua utilizada para las simulaciones no parece haber influido en los resultados de escurrimiento. Además, las pequeñas cantidades de plaguicidas perdidas en dicho proceso están mostrando que en este estudio no se habría sobrepasado la capacidad de perder plaguicidas frente a lluvias de elevada intensidad. Algunos autores han señalado que bajo lluvia natural, la SD es más eficiente para controlar el escurrimiento, la erosión y la pérdida de plaguicidas con respecto al uso de lluvia simulada (Fawcett et al., 1994).
La retención en el suelo, cuando pudo ser cuantificada, mostró en 4 plaguicidas la capacidad superadora de R sobre S. Además, las cantidades retenidas en el suelo fueron importantes y estuvieron en relación con las cantidades de plaguicida aplicadas (Figura 2b). Esto está demostrando que la intensificación de la secuencia de cultivos, tal como está planteada, fue una de las claves para reducir la pérdida de algunos plaguicidas de los agroecosistemas (Figura 1).
Los resultados alcanzados estuvieron condicionados por las características del dispositivo experimental: el momento de muestreo, realizado luego de la cosecha del cultivo de maíz en R y de soja en S y diferencias entre los dos tratamientos en dosis, momento de aplicación, tiempo transcurrido desde la última aplicación e historia de uso previo a la implementación del ensayo. Por ello, éstos reflejan los efectos de largo plazo del uso de plaguicidas frente a diferentes relaciones suelo/ cultivos/clima acumuladas, en lapsos de tiempo que involucran desde el manejo anterior de plaguicidas al inicio del ensayo hasta lo sucedido en las últimas aplicaciones. Para poder comprender su dinámica con mayor profundidad y conocer la importancia de su interacción con las complejas relaciones suelo/cultivo/clima en la disipación (Hang et al., 2011), es necesario realizar muestreos al inicio y al fin del ciclo de los diferentes cultivos y en situaciones climáticas contrastantes, profundizar el estudio de la cantidad y calidad de residuos bajo SD sobre la disipación de plaguicidas en condiciones controladas e implementar ensayos en el que se incluya el efecto del grado de la pendiente sobre la pérdida de plaguicidas en agua de escurrimiento y en los sedimentos de erosión bajo lluvias de elevada intensidad.
CONCLUSIONES
La evaluación de dos secuencias de cultivos contrastantes bajo SD permitió caracterizar las diferencias en algunas propiedades físicas, químicas y biológicas del suelo, y relacionarlas con la presencia de plaguicidas en escurrimientos y en el perfil de suelo hasta un metro de profundidad. La rotación de cultivos disminuye la pérdida de plaguicidas por escurrimiento y aumenta su retención en el suelo debido a una mejora en las propiedades edáficas con respecto al monocultivo.
La biomasa de residuos y un conjunto de propiedades edáficas cerca de la superficie del suelo fueron capaces de explicar la disminución de ciproconazol en el escurrimiento y el aumento de su retención en el suelo cuando se intensificó la secuencia de cultivos. Además, diferentes combinaciones de propiedades del espesor superficial combinadas con características específicas de los plaguicidas favorecieron la retención de azoxistrobina, clorpirifós, 2,4-D y glifosato en la secuencia intensificada. La historia previa de uso de 2,4-D y atrazina al inicio del experimento fue relevante, al encontrarse concentraciones similares a lo largo del primer metro de profundidad.
Debería profundizarse la investigación sobre las interacciones entre propiedades edáficas generadas por los sistemas de cultivo intensificados bajo SD en el control de la pérdida y retención de plaguicidas. Un mayor tiempo de permanencia dentro de la matriz edáfica, otorga un tiempo adicional para su oclusión y/o para su degradación dentro del perfil.
AGRADECIMIENTOS
A María José Beribe por su colaboración en el análisis estadístico. A Diego Colombini, Fabio Villalba y Fernando Rimatori por los trabajos a campo. A INTA por los fondos otorgados a través de la beca de formación INTA y el PNSuelo 1134020.
BIBLIOGRAFIA
1. Alletto, L; Y Coquet; P Benoit; D Heddadj & E Barriuso. 2010. Tillage management effects on pesticide fate in soils. A review. Agron. Sustain. Dev. 30:367-400.
2. Aparicio, VC, E De Gerónimo; K Hernández Guijarro; D Pérez; R Portocarrero & C Vidal (Eds). 2015. Los plaguicidas agregados al suelo y su destino en el ambiente. INTA.
3. APHA-AWWA-WPCF. American Public Health Association (APHA), American Water Works Association (AWWA) y Water Pollution Control Federation (WPCF). 1989. Métodos Normalizados para el análisis de aguas potables y residuales. Madrid: Díaz de Santos.
4. Azcárate, MP; JC Montoya & WC Koskinen. 2015. Sorption, desorption and leaching potential of sulfonylurea herbicides in Argentinean soils. J. Environ. Sci. Health. B., 50:229-37.
5. Barriuso, E; C Feller; R Calvet & C Cerri. 1992. Sorption of atrazine terbutryn and 2,4-D herbicides in two Brazilian oxisols. Geoderma, 53:155-167.
6. Bezerra de Oliveira, L. 1968. Determinaçao da macro e microporosidade pela "mesa de tensao'' emmostras de solo com estrutura indeformada. Pesquisa Agrop. Bras., 3: 197-200.
7. Bray RH & LT Kurtz. 1945. Determination of total, organic and available forms of phosphorus in soils. Soil Sci., 59:39-45.
8. Bremner, JM. 1965. Nitrogen Availability Indexes. En: CA Black; DD Evans; JL White; LL Ensminger & FE Clark. (Eds.). Methods of Soil Analysis. Pp. 1179-1237 ASACSSA- SSSA.
9. Brodeur, JC; M Sánchez; L Castro; DE Rojas; D Cristos; MJ Damonte; MB Poliserpi; MF D'Andrea & AE Andriulo. 2017. Accumulation of current-use pesticides, cholinesterase inhibition and reduced body condition in juvenile one-sided livebearer fish (Jenynsia multidentata) from the agricultural Pampa region of Argentina. Chemosphere, 185:36-46.
10. Buerge, IJ; T Poiger; MD Müller & HR Buser. 2006. Influence of pH on the stereoselective degradation of the fungicides epoxiconazole and cyproconazole in soils. Environ. Sci. Technol., 40:5443-5450.
11. Burke W; D Gabriela & J Bruma.1986. Soil Structure Assessment, A.A. Balkema, Rotterdam, The Netherlands.
12. Cambardella, CA & ET Elliot.1992. Particulate soil organicmatter changes across a grassland cultivation sequence. Soil Sci. Soc. Am. J., 56: 777-783.
13. Carter, MR. 1990. Relative measures of soil bulk density to characterize compaction in tillage studies on fine Sandy loams. Canadian Journal of Soil Science, Ottawa, 70:425-433.
14. Chai, LK; MH Wong & HC Bruun Hansen. 2013. Degradation of chlorpyrifos in humid tropical soils. J. Environ. Manage., 125:28-32.
15. Comerford N. 2013. Soil: Largest reactor on the planet? https://soilsmatter.wordpress.com/2013/12/02/soillargest- reactor-on-the-planet/ Fecha de último acceso: 04/10/2018
16. D'Acunto, L; JF Andrade; SL Poggio & M Semmartin. 2018. Diversifying crop rotation increased metabolic soil diversity and activity of the microbial community. Agric. Ecosyst. Environ., 257:159-164.
17. Darder, ML. 2018. Escurrimiento superficial de la cuenca alta del Arroyo Pergamino. Impacto del uso de la tierra y la posición en el paisaje sobre la calidad del agua y los sedimentos. Tesis de Maestría. Universidad de Buenos Aires.
18. De Gerónimo, E; V Aparicio; S Bárbaro; R Portocarrero; S Jaime & JL Costa. 2014. Presence of pesticides in surface water from four sub-basins in Argentina. Chemosphere, 107:423-431.
19. Demonte, LD; N Michlig; M Gaggiotti; CG Adam; HR Beldoménico & MR Repetti. 2018. Determination of glyphosate, AMPA and glufosinate in dairy farm water from Argentina using a simplified UHPLC-MS/MS method. Sci Total Environ, 645:34-43.
20. Di Rienzo, JA; F Casanoves; MG Balzarini; L Gonzalez; M Tablada & CW Robledo. 2013. Grupo InfoStat, Facultad Ciencias Agrarias, Universidad Nacional de Córdoba, Argentina. http://www.infostat.com.ar
21. Divito, GA, HRS Rozas, HE Echeverría; GA Studdert & N Wyngaard. 2011. Long term nitrogen fertilization: Soil property changes in an Argentinean Pampas soil under no tillage. Soil Tillage Res., 114:117-126.
22. Douglas, JT & MJ Goss. 1982. Stability and organic matter of surface soil aggregates under different methods of cultivation and in grassland. Soil Till Res, 2:155-175.
23. European Commission (EC). 2015. Directorate-general for Health and Food Safety, Safety of the Food Chain Pesticides and Biocides, SANTE/11945/2015, guidance document on analytical quality control and method validation procedures for pesticides residues analysis in food and feed. Supersedes SANCO/12571/2013. Implemented by 01/01/2016.
24. Fawcett, RS; BR Christensen & DP Tierney. 1994. The impact of conservation tillage on pesticide runoff into Surface water: a review and analysis. J. Soil Water Conserv., 49:126-135
25. Fischer, RA & DJ Connor. 2018. Issues for cropping and agricultural science in the next 20 years. F. Crop. Res., 222:121-142.
26. Gebremariam, SY; MW Beutel; M Flury; JB Harsh & DR Yonge. 2012. Nonsingular adsorption/desorption of chlorpyrifos in soils and sediments: experimental results and modeling. Environ. Sci. Technol., 46:869-875.
27. Gil RC & A Garay. 2001. La siembra directa y el funcionamiento sustentable del suelo. En: JL Panigatti; D Buschiazzo & H Marelli (Eds.). Siembra Directa II. Ediciones INTA.
28. Gimsing, AL; OK Borggaard; OS Jacobsen; J Aamand & J Sørensen. 2004. Chemical and microbiological soil characteristics controlling glyphosate mineralization in Danish surface soils. Appl. Soil Ecol., 27:233-242.
29. Hang, S; E Barriuso & S Houot. 2003. Behavior of 14C-Atrazine in Argentinean topsoils under different cropping managements. J. Environ. Qual., 32:2216-2222.
30. Hang, S; EA Rampoldi & GJ Negro. 2011. Herbicides Behaviour in Non Tillage Systems. En: KD Piotrowski (Ed.). Herbicides: Properties, Crop Protection and Environmental Hazards. Nova Science Publishers, Inc., pp. 121-159.
31. Harman WL, E Wang & JR Williams. 2004. Reducing atrazine losses: Water quality implications of alternative runoff control practices. J. Environ. Qual., 33:7-12.
32. Herrero-Hernández, E; MS Andrades; A Álvarez-Martín; E Pose-Juan; MS Rodríguez-Cruz & MJ Sánchez-Martín. 2013. Occurrence of pesticides and some of their degradation products in waters in a Spanish wine region. J. Hydrol. 486: 234-245.
33. Hillel D, 1980. Fundamentals of Soil Physics. Academic Press, New York.Hudson, N. 1982. Edición, ilustrada. Reverte, pp. 352
34. INTA. 1972. Carta de Suelos de la República Argentina. Hoja 3360-32 Pergamino, provincia de Buenos Aires. INTA. Argentina.
35. Irizar, AB. 2010. Cambios en las reservas de materia orgánica del suelo y sus fracciones granulométricas: efecto de la secuencia de cultivo, del sistema de labranza y de la fertilización nitrogenada. Tesis de Maestría. Universidad de Buenos Aires
36. Irizar, AB; LA Milesi Delaye & AE Andriulo. 2015. Projection of soil organic carbon reserves in the argentine rolling pampa under different agronomic scenarios. Relationship of these reserves with some soil properties. Open Agric. J., 9:30-41.
37. Irurtia, C & R Mon. 1994. Microsimulador de lluvia para determinar infiltración a campo. Publicación N° 176. SAGPyA, INTA. CIRN, Instituto de Suelos, Castelar. Argentina. 18 p.
38. ISO/FDIS 11274. 1998. Soil quality-determination of waterretention characteristic, Laboratory methods.
39. Jenkinson, DS & DS Powlson. 1976. The effect of biocidal treatments on metabolism in soil. I. Fumigation with chloroform. Soil Biol. Biochem., 8:167-177.
40. Johnson, GV. 1987. Sulfate: Sampling testing, and calibration. En: JR Brown (Ed.). Soil testing: Sampling correlation, calibration and interpretation. Pp. 89-96. SSSA Spec. Publ. 21. SSSA, Madison, WI.
41. Kaufman, DD; BA Russell; CS Helling & AJ Kayser. 1981. Movement of cypermethrin, decamethrin, permethrin, and their degradation products in soil. J Agr Food Chem, 29:239-245.
42. Keeney, D. 1982. Nitrogen-Availability Indices. En: Page AL (Ed). Methods of Soil Analysis. Part 2, Chemical and Microbiological Properties. Nº 9. Pp 711-733. Soil Science Society of America, Madison, Wisconsin, EEUU.
43. Kjær, J; P Olsen; M Ullum & R Grant. 2005. Leaching of glyphosate and amino-methylphosphonic acid from Danish agricultural field sites. J. Environ. Qual., 34:608- 620
44. Klute, A (Ed). 1986. Methods of Soil Analysis, Part 1. Physical and Mineralogical Methods. Seconds Edition. Soil Science Society of America Book Series 5. Madison, Wisconsin USA
45. Locke, MA & SS Harper. 1991. Metribuzin degradation in soil: I- Effects of residue amendment, metribuzin level, and soil depth. Pestic. Sci., 31:221-237.
46. Mamy L & E Barriuso. 2007. Desorption and time-dependent sorption of herbicides in soils. Eur. J. Soil Sci., 58:174-187.
47. Marino D & A Ronco. 2005. Cypermethrin and chlorpyrifos concentration levels in surface water bodies of the Pampa Ondulada, Argentina. Bull. Environ. Contam. Toxicol., 75:820-826.
48. Martínez, JP; PA Barbieri; G Cordone; HR Sainz Rozas; HE Echeverría & GA Studdert. 2014. Secuencias con predominio de soja y su efecto sobre el carbono orgánico. En: XXIV Congreso Argentino de la Ciencia del Suelo, 5-9 de Mayo, Bahía Blanca, Argentina
49. Merini LJ, V Cuadrado; CG Flocco & AM Giulietti. 2007. Dissipation of 2,4-D in soils of the Humid Pampa region, Argentina: A microcosm study. Chemosphere, 68:259- 265.
50. Milesi Delaye, LA; AB Irizar; GO Magrín & AE Andriulo. 2014. Perspectivas para el stock orgánico del suelo de la Pampa Ondulada bajo diferentes escenarios agronómicos y climáticos. En: C Pascale Medina; MM Zubillaga; MA Taboada (Eds). Suelos, producción agropecuaria y cambio climático: avances en la Argentina. Pp 67-96. Ministerio de Agricultura, Ganadería y Pesca de la Nación.
51. Milesi Delaye, LA; AB Irizar; AE Andriulo & B Mary. 2013. Effect of continuous agriculture of grassland soils of the argentine rolling pampa on soil organic carbon and nitrogen. Appl. Environ. Soil Sci., 2013:1-17.
52. Montoya, JC; Costa, JL; R Liedl; F Bedmar & PE Daniel. 2006. Effects of soil type and tillage practice on atrazine transport through intact soil cores. Geoderma, 137:161- 173.
53. Nelson, DW & LE Sommers.1996. Total Carbon, Organic carbon and organic matter. In: Methods of soil analysis. Part 3. Chemical methods-SSA Book series nº5. Bartels managing.
54. PPDB. 2018. The Pesticide Properties Data Base. Agriculture and Environment Research Unit, University of Hertfordshire, Hatfield, Herts
55. Principiano, MA & HA Acciaresi. 2018. Estado de situación del uso de herbicidas en cultivos extensivos agrícolas de la región noroeste de la provincia de Buenos Aires y el impacto ambiental asociado. https://inta.gob.ar/sites/default/ files/inta_pergamino_relevamiento_de_uso_de_herbicidas-_ 07-11-2018.pdf. Fecha de último acceso: 04/10/2018
56. Proctor RR. 1933. Fundamental principles of soil compaction. Eng. New Record 11, 246 pp.
57. Rampoldi, EA; S Hang & E Barriuso. 2014. Carbon- 14-Glyphosate Behavior in Relationship to Pedoclimatic Conditions and Crop Sequence. J. Environ. Qual. 43(2):558-567.
58. Reddy, KN & MA Locke. 1998. Sulfentrazone sorption, desorption, and mineralization in soils from two tillage systems. Weed Sci., 46:494-500.
59. Reemtsma, T; L Alder & U Banasiak. 2013. Emerging pesticide metabolites in groundwater and surface water as determined by the application of a multimethod for 150 pesticide metabolites. Water Res., 47:5535-5545.
60. Regaldo, L; MF Gutierrez; U Reno; V Fernández; S Gervasio; MR Repetti & AM Gagneten. 2017. Water and sediment quality assessment in the Colastiné-Corralito stream system (Santa Fe, Argentina): impact of industry and agriculture on aquatic ecosystems. Environ Sci Pollut R, 25(7):6951-6968.
61. RETAA. 2013. Relevamiento de Tecnología Agropecuaria Aplicada, Bolsa de Cereales de Buenos Aires. www. bolcereales.com.ar/retaa. Fecha de último acceso: 04/10/2018
62. Ruan, H, LR Ahuja; TR Green & JG Benjamin. 2001. Residue cover and surface-sealing effects on infiltration: numerical simulations for field applications. Soil Sci. Soc. Am. J., 65:853-861
63. Sasal, MC; MG Castiglioni & MG Wilson. 2010. Effect of crop sequences on soil properties and runoff on natural- rainfall erosion plots under no tillage. Soil Tillage Res., 108:24-29.
64. Sasal, MC; J Léonard; A Andriulo & H Boizard. 2017. A contribution to understanding the origin of platy structure in silty soils under no tillage. Soil Till Res, 173:42-48.
65. Schnürer, J & T Rosswall. 1982. Fluorescein diacetate hydrolysis as a measure of total microbial in soil and litter. Appl. Environ. Microbial., 43:1256-61.
66. Schreiner, VC; E Szöcs; AK Bhowmik; MG Vijver & RB Schäfer. 2016. Pesticide mixtures in streams of several European countries and the USA. Sci. Total Environ. 573:680-689.
67. Simonsen, L; IS Fomsgaard, B Svensmark & NH Spliid. 2008. Fate and availability of glyphosate and AMPA in agricultural soil. Journal of Environmental Science and Health, Part B: Pesticides, Food Contaminants, and Agricultural Wastes, 43:365-375.
68. Sommers, LE & DDW Nelson. 1972. Determination of total phosphorous in soil. Soil Sci. Am. Proc. 36:902-904.
69. Sparks, DL; AL Page; PA Helmke; RH Loeppert; PN Soltanpour; MA Tabatabai & ME Sumner (Eds). 1996. Methods of soil analysis. Part 3: Chemical methods. Soil Science Society of America Book Series 5. Madison, Wisconsin, USA.
70. Tabatabai, MA. 1982. Sulfur. En: RL Page; RH Miller & DR Keeney. Methods of Soil Analysis: Chemical and Microbiological Properties. 2.ed. pp. 501- 538. Madison.
71. Tiemann, LK; AS Grandy; EE Atkinson; E Marin-Spiotta & MD McDaniel. 2015. Crop rotational diversity enhances belowground communities and functions in an agroecosystem. Ecology letters, 18:761-771.
72. Vance, ED; PC Brookes & DS Jenkinson. 1987. An extraction method for measuring soil microbial biomass C. Soil Biology & Biochemistry, 19:703-707
73. Vereecken, H. 2005. Mobility and leaching of glyphosate: a review. Pest Management Science, 61:1139-1151.
74. Vonberg, D; J Vanderborght; N Cremer; T Pütz; M Herbst & H Vereecken. 2014. Twenty years of long-term atrazine monitoring in a shallow aquifer in western Germany. Water Res. 50:294-306.
75. Walkley, A & I Black. 1934. An examination of the Degtjareff method and a proposed modification of the chromic matter and a proposed modification of the chromic acid titration method. Soil Sci., 34: 29-38.
76. Weaver, RW; S Angle; P. Bottomley; D Bezdicek; S Smith; A Tabatabai & A Wollum (Eds). 1994. Methods of Soil Analysis, Part 2. Microbiological and Biochemical Properties. Soil Science Society of America Book Series 5. Madison, Wisconsin, USA
77. Zanini, GP, C Maneiro; C Waiman; JA Galantini & RA Rosell. 2009. Adsorption of metsulfuron-methyl on soils under no-till system in semiarid Pampean Region, Argentina, Geoderma, 149:110-115.