BIOLOGÍA DEL SUELO
Grupos bacterianos en un argiudol típico con aplicación de glifosato: influencia en bacterias del nitrógeno
Bacterial groups in a typical argiudol with application of glyphosate: influence on bacteria of nitrogen
Mónica Fabiola Boccolini*1; Sofía Moyano1; Mariana Bonetto1; Tomás Baigorria1; Cristian Cazorla1
1 INTA Marcos Juárez
* Autor de contacto: boccolini.monica@inta.gob.ar
Recibido: 6/7/2018
Recibido con revisiones: 23/5/2019
Aceptado: 25/5/2019
RESUMEN
Los microorganismos de suelo son los responsables de numerosas funciones y pueden actuar como "marcador biológico",
reflejando rápidamente los efectos negativos de los plaguicidas que son comúnmente usados. Este estudio evalúa el efecto
de dos dosis de glifosato sobre la actividad microbiana y C de la biomasa microbiana del suelo, abundancia de grupos
bacterianos y la estructura de la comunidad de bacterias oxidantes del amoníaco (BOA) en un suelo Argiudol típico. Se
realizó un bioensayo con suelo agrícola de Marcos Juárez, Córdoba. Los tratamientos fueron suelo sin glifosato (control), y
con 3,1 (dosis a campo) y 31 mg ia.kg-1 suelo (dosis exceso). A los 3, 7, 14 y 21 días de la aplicación se realizó recuento
de bacterias heterótrofas, celulolíticas, fijadoras de N y nitrificantes, y se determinó la respiración microbiana (RM); C de
la biomasa microbiana (C-BM) y la actividad enzimática por hidrólisis del diacetato fluoresceína. Además se determinó la
diversidad genética de las BOA mediante electroforesis en gel de gradiente desnaturalizante. Las bacterias del ciclo del N
mostraron incrementos en la abundancia con ambas dosis; mientras que las del C no fueron afectadas y al igual que la RM
estuvieron condicionadas por los días transcurridos; mientras que el C-BM no cambió debido probablemente al contenido
de materia orgánica del suelo (MOS). La actividad enzimática disminuyó con la mayor dosis del herbicida al día 14. La
diversidad de BOA fue mayor con la dosis a campo a los 7 días. Bajo las condiciones estudiadas, las bacterias del ciclo del
N y la actividad enzimática mostraron mayor sensibilidad al glifosato que el resto de los bioindicadores. Este estudio suma
evidencias de que el efecto del glifosato sobre la microbiota del suelo es variable y está condicionado por factores edáficos
principalmente por la MOS y dosis utilizadas.
Palabras clave: Bioindicadores; Electroforesis en gel de gradiente desnaturalizante (DGGE); Herbicida
ABSTRACT
Soil microorganisms are responsible for many functions and could be considered "biological markers" as these quickly reflect
the negative effects of pesticides that are commonly used. This study evaluates the effect of two doses of glyphosate
on soil microbial activity and carbon from microbial biomass, on the abundance of bacterial groups, and structure of the
community of ammonia-oxidizing bacteria (AOB) in a typical Argiudoll. A bioassay was carried out with the agricultural soil
from Marcos Juárez, Córdoba. The treatments were: soil without glyphosate (control); soil with application of 3,1 mg ai kg-1 (field dose) and another of 31 mg ai kg-1 (excess dose). At 3, 7, 14 and 21 days after the glyphosate application, the heterotrophic,
cellulolytic, N-fixing and, nitrifying bacteria were counted, and microbial respiration (MR); carbon from microbial
biomass (C-MB) and the enzymatic activity by fluorescein diacetate hydrolysis were determined. In addition, the genetic
diversity of the AOB was determined by denaturing gradient gel electrophoresis. Bacteria related to the N cycle showed
increases in the abundance with both doses of glyphosate, while the bacteria related to the C cycle did not show significant
differences and, like MR, were conditioned by the incubation days. While the C-MB did not show differences probably due
to the soil organic matter content (SOM). The enzymatic activity decreased with the highest dose of the herbicide, at 14
days. The diversity of AOB was greater at field dose and after 7 days. Under evaluated conditions, N cycle bacteria and
its enzymatic activity showed greater sensitivity to glyphosate than other bioindicators. This study adds evidence to the
glyphosate effects on soil microbiota which are variable and depend on edaphic factors, mainly SOM and the used doses.
Keywords: Bioindicators; Denaturing gradient gel electrophoresis (DGGE); Herbicide
INTRODUCCIÓN
La Argentina es el décimo país agrícola en el
mundo, con 31 millones de hectáreas dedicadas
a la agricultura. El 74% de la superficie agrícola
es ocupada por los cultivos transgénicos (soja,
maíz y algodón) y en el 78,5% de la misma
se realiza siembra directa (Aparicio et al., 2013).
Estas tecnologías conllevan al uso de productos
químicos durante los períodos de barbecho,
lo cual sitúa al glifosato como el herbicida más
comúnmente utilizado en el país (Aparicio et al.,
2013). Según un informe del mercado argentino
de fitosanitarios (CASAFE, 2012), el glifosato
sufrió un incremento del 24% en facturación
en 2012 con respecto al 2011.
Los microorganismos de suelo son los responsables
de numerosas funciones incluyendo el ciclo
de los nutrientes, la formación de agregados
de suelo y el ciclado de la materia orgánica (MO);
es así que, los impactos sobre la comunidad microbiana
podrían afectar la fertilidad del suelo y la
producción de los cultivos (Nguyen et al., 2016).
Debido a una respuesta rápida, los microorganismos
pueden actuar como "un marcador biológico",
reflejando los efectos negativos de los plaguicidas
que son comúnmente usados (Filip, 2002).
Los parámetros bioindicadores de suelo más
utilizados en estudios con aplicación de glifosato
y otros plaguicidas son la respiración microbiana
(RM) y C de la biomasa microbiana (C-BM),
coeficiente metabólico (qCO2), actividad enzimática
global y específica, así como también, indicadores
basados en técnicas moleculares, como
la diversidad genética de bacterias totales y de
grupos funcionales bacterianos como los del ciclo
del N (Araújo et al., 2003; Zabaloy et al., 2008,
2012, 2016; Angelini et al., 2013; Panettieri
et al., 2013; Nakatani et al., 2014; Mukherjee
et al., 2016).
En particular, Zabaloy et al. (2016) reportaron
a la comunidad de bacterias oxidantes del amoníaco
(BOA) como biomarcadores de toxicidad
potencial de glifosato. También Angelini et al.
(2013) y Frioni, (2006) reportan una respuesta
de sensibilidad en bacterias nitrificantes y fijadoras
de N al aplicar glifosato y otros herbicidas
en el suelo.
Numerosas investigaciones han reportado
efectos diversos y contradictorios del glifosato sobre
las comunidades microbianas en los agroecosistemas.
Esto es debido a que, si bien el glifosato
puede interferir en la síntesis de algunos compuestos
que intervienen en el crecimiento microbiano
(Nguyen et al., 2016) afectando procesos
biológicos y miembros de la comunidad (Zabaloy
et al., 2008), también se ha observado que podría
actuar como fuente de C, N y P para diversos
microorganismos (Van Eerd et al., 2000; Gomez
et al., 2009; Mijangos et al., 2009; Panettieri
et al., 2013).
La degradación microbiana es considerada
el principal proceso que determina la persistencia
de los plaguicidas en el suelo (Kogan & Alister,
2013; Aparicio et al., 2015). El glifosato
es una molécula fuertemente quelante y su capacidad
de adsorción a la matriz del suelo hace
que se acumule y sea muy persistente afectando
su degradación. En el medio ambiente presenta
una vida media de 4 a 180 días (revisado por
Aparicio et al., 2015). La persistencia depende
entre otros factores, del contenido de MO, textura,
mineralogía y pH del suelo (Kogan & Alister,
2013; Okada et al., 2016). Así, cada tipo de suelo
tendría una tasa variable de descomposición;
de grado de adsorción a las partículas del suelo
y de toxicidad de glifosato o sus metabolitos para
las poblaciones microbianas susceptibles (Newman
et al., 2016).
Si bien existen trabajos sobre los efectos del
glifosato en la microbiota de suelos Molisoles
de la región pampeana Argentina (Zabaloy et al.,
2008, 2012, 2016; Gomez et al., 2009; Rörig,
2012; Allegrini et al., 2015; Guijarro et al.,
2018), hasta donde alcanza nuestro conocimiento,
existe poca información sobre los efectos
de dosis crecientes del herbicida en un Argiudol
típico. Además no se han reportado trabajos que
caractericen la diversidad genética y estructura
de las comunidades microbianas sensibles a la
aplicación de glifosato como las BOA en este tipo
de suelo. Por lo tanto, el objetivo de este trabajo
fue determinar el efecto de dos dosis de glifosato
(utilizada a campo y en exceso) sobre la actividad
y C de la biomasa microbiana del suelo, abundancia
de grupos funcionales bacterianos de los ciclos del C y N; y la estructura de la comunidad
de BOA en un suelo Argiudol típico bajo condiciones
controladas.
MATERIALES Y MÉTODOS
Descripción del suelo y preparación
de los microcosmos
Se realizó un bioensayo con suelo proveniente
de un lote de historial agrícola con aplicación del
herbicida en la estación experimental agropecuaria
INTA Marcos Juárez (Córdoba). El suelo está
clasificado como Argiudol típico perteneciente
a la serie Marcos Juárez, con capacidad de uso
I (INTA, 1978). La serie presenta un horizonte
A (0-19 cm de profundidad) con características
propias de un suelo franco-limoso (25% arcilla,
69% limo y 6% arena). El contenido de materia
orgánica (MO) es de 3,26%; nitrógeno (N) total
0,18% y 36 ppm de fósforo (P Bray). El pH
es de 6,4; la CIC 19,3 cmolc. Kg-1 y la saturación
de bases es del 91% (INTA, 1978). De acuerdo
al contenido de MO, se lo puede clasificar dentro
de los suelos con contenido medio (2 a 4%) (Conti,
2000).
Se extrajo suelo de 0-10 cm de profundidad
con pala y se almacenó a 4 ºC hasta su procesamiento.
En el laboratorio se dejó a temperatura
ambiente durante 24 h y se tamizó por 4 mm.
Los microcosmos fueron preparados con 200
g de suelo que se colocaron en bandejas plásticas.
Un total de 36 bandejas fueron utilizadas
(3 dosis de herbicida x 4 tiempos de muestreo
x 3 repeticiones), las que luego se pre incubaron
a 25°C durante 48 h.
Se utilizó glifosato de formulación comercial
(74,7%) de base seca de ingrediente activo (ia)
Roundup Ultramax de Monsanto para la preparación
de las dosis, las que se ajustaron de acuerdo
al tamaño de la bandeja y al peso de suelo utilizado
considerando su densidad de 1,2 toneladas
por hectárea (10 cm de profundidad). Las aplicaciones
se realizaron con dispersor. Los tratamientos
evaluados fueron: a) Suelo sin agregado
de glifosato (control), b) Suelo con dosis de glifosato
recomendada a campo de 1,5 kg de producto
por hectárea (3,1 mg ia.Kg-1 suelo (s)) y c)
Suelo con una dosis de glifosato 10 veces mayor
a la recomendada de 15 kg de producto por
hectárea (31 mg ia.Kg-1 s) para simular una concentración
potencial diferente al uso convencional
del herbicida en la zona (Zabaloy et al., 2008).
Las bandejas con los tratamientos de aplicación
de glifosato y con el tratamiento control (a las que
se le adiciono sólo agua destilada) fueron incubadas
en condiciones controladas de temperatura
(25°C) y humedad (75% de capacidad de campo).
La humedad se mantuvo con riego en forma
periódica con agua destilada teniendo en cuenta
el peso de la bandeja. Los muestreos fueron destructivos
y se realizaron a los 3, 7, 14 y 21 días
de realizadas las aplicaciones.
Determinaciones microbiológicas
Abundancia de grupos funcionales bacterianos
En todos los casos para el recuento bacteriano
se realizaron diluciones decimales seriadas
de 1 en 10 utilizando solución salina o fisiológica
(0,9% NaCl) como diluyente a partir de 1
g de suelo.
La abundancia de bacterias heterótrofas aerobias
totales se estimó a través de la técnica de recuento
de viables en placa en medio agar tripticasa
soya (ATS) (Frioni, 2006). Se sembraron
0,1 mL de las diluciones 10-2 hasta 10-5 por duplicado
en cada placa con 25 mL de medio. Posteriormente
se incubaron a 28 ºC durante 48 h.
Para fijadoras de N de vida libre se utilizó recuento
en placa con medio solido selectivo libre de N
y C como fuente de energía de acuerdo con Frioni
(2006). Se sembraron 0,1 mL de las diluciones
10-2, 10-3 y 10-4 por duplicado en cada placa con
25 mL de medio y posteriormente se incubaron
a 28 ºC durante 72 h. En ambos casos se contaron
aquellas placas cuyas diluciones contenían
entre 30 y 300 colonias y el número de bacterias
fue expresado como log10 UFC (Unidades formadoras
de colonias) g-1 de suelo.
Para las bacterias nitrificantes y celulolíticas
se utilizó la técnica del Número más probable
(NMP) (Alexander, 1965). En nitrificantes
se utilizó medio líquido selectivo con (NH4)2SO4 y CaCO3 según Frioni (2006). Las diluciones fueron
sembradas por triplicado (1 mL) en tubos que
contenían 1,5 mL de medio, luego se incubaron
a 28 ºC durante 28 días. La lectura se realizó con la adición de 10 gotas de H2SO4 concentrado
y 10 gotas de difenilamina sulfúrica detectándose
cambio de color a azul. En celulíticos se utilizó
medio líquido selectivo al que se le adicionaron
tiras de papel de filtro semi sumergidas en el medio
(Frioni, 2006). Se sembró 1 mL de las diluciones
por triplicado en tubos con 9 mL de medio
y posteriormente se incubaron a 28 ºC durante
15 días. La lectura se realizó observando cambio
de color en el papel, lo que se consideró un resultado
positivo (degradación). Los resultados fueron
expresados como log10 del número de bacterias
g-1 de suelo.
Actividades microbianas del suelo
La actividad enzimática general del suelo
se determinó a partir de la hidrolisis del diacetato
de fluoresceína (DAF) propuesta por Schnurer &
Rosswall, (1982) y descripta por Alef (1995). A 1
g de suelo en 15 mL de buffer fosfato sodio (60
mM, pH 7,6) se le adicionó 10 mL de solución sustrato
DAF (4,8 mM en acetona), se agitó durante
2 h a 20 ºC. Posteriormente se filtró la suspensión
y se midió el filtrado a 490 nm con espectrofotómetro.
La actividad hidrolítica fue expresada como
μg fluoresceína h-1 g-1 de suelo seco (ss).
La respiración microbiana de suelo (RMS) fue
determinada por la liberación de CO2 a partir 30 g
de suelo en frascos herméticamente cerrados a 25
ºC durante 7 días en oscuridad (Jenkinson & Powlson,
1976). El CO2 fue capturado con NaOH (0,2 N)
y titulado con H2SO4 (0,1N) en presencia de BaCl2 al 20% y fenolftaldeína. La concentración de C liberado
fue expresada como μg C-CO2 d-1 g-1 ss.
Contenido de C de la biomasa microbiana
El C de la biomasa microbiana (C-BM) fue
medido por el método de fumigación-extracción
(Vance et al., 1987). Al suelo seco (7,5 g) se le
agregaron 2,5 mL de agua destilada en un tubo
de 50 mL y se incubó en forma no hermética durante
15 h a 30°C en oscuridad. Luego se fumigó
con 0,4 mL de cloroformo durante 30 min tapando
herméticamente. Los blancos (no fumigados)
fueron incubados bajo las mismas condiciones
que los fumigados. Posteriormente se agregaron
30 mL de solución extractante (0,5 mol/L K2SO4),
agitando 1 h, se centrifugó y filtró. Luego se extrajeron
4 mL del extracto y se le adicionaron
1 mL de 0,0667 M de K2Cr2O7 y 4 mL de H2SO4 concentrado. Finalmente se realizó la digestión
a 140°C durante 30 min y se midió la absorbancia
a 590 nm con espectrofotómetro. El C extraído
fue expresado como μg C g-1 suelo seco.
El cociente metabólico (qCO2) fue obtenido
como la proporción de C-CO2 de la muestra
de suelo liberado durante 7 días por unidad
de biomasa microbiana (Anderson & Domsch,
1993). Los resultados fueron expresados como
μg C-CO2 d-1 μg-1 de C-BM.
Diversidad y estructura de la comunidad de
bacterias oxidantes del amoníaco (BOA)
A partir de 0,5 g de suelo se realizó la extracción
de ADN con kit Fast DNA Spin para suelos
(MP Biomedicals). La calidad del ADN extraído
se verificó mediante electroforesis en agarosa
al 1% y la concentración se midió a 260 nm con
nano espectrofotómetro. Para la amplificación
de los genes 16S ARNr de las BOA se realizó
la técnica de reacción en cadena de la polimerasa
(PCR) anidada o Nested PCR. En la primera amplificación
se utilizaron los cebadores específicos
CTO F189 y R654 (Kowalchuk et al., 1997) que
flanquean una región de 465 bp ubicada entre los
dominios variables V2 y V3 del ADN/ARNr 16S.
El producto generado fue utilizado como templado
para la segunda amplificación con los cebadores
universales F341-GC y R534 (Muyzer et al.,
1993) que amplifican un fragmento de aproximadamente
233 bp del dominio V3 ADN/ARNr 16S.
La primera reacción de PCR (25 μL volumen
final) se realizó con buffer Taq polimerasa
1X (Promega) más 1,5 mM de MgCl2, 0,2 μM de
cada cebador, 1,5 U de enzima Go Taq (Promega),
5% (v/v) de dimetilsufóxido (DMSO), 0,2
mM de dNTPs (Promega), 0,2 μg/μL albumina
sérica bovina (BSA) (Fermentas), 80 ng de ADN
y agua destilada estéril. En la segunda reacción
(40 μL volumen final) se utilizó buffer Taq polimerasa
1X (Promega) más 1,5 mM de MgCl2,
0,1 μM de cada cebador, 1 U de enzima Go Taq
(Promega), 5% (v/v) dimetilsufóxido (DMSO), 0,2
mM de dNTPs (Promega), 0,2 μg/μL albumina
sérica bovina (BSA) (Fermentas) y se agregó 1,5 μL de producto de PCR de la primera reacción.
Las condiciones de amplificación consistieron
en una desnaturalización inicial de 5 min a 94
ºC, seguida de 35 ciclos de 30 seg de desnaturalización
a 94°C, 45 seg de annealing a 55°C y 45
seg de extensión a 72°C, con un paso de extensión
final de 10 min a 72ºC.
Todos los productos PCR fueron chequeados
en agarosa al 1% para verificar su tamaño
y calidad. Posteriormente, los amplicones fueron
separados por electroforesis en gel de gradiente
desnaturalizante o DGGE. El gel se preparó con poliacrilamida
al 8% con un gradiente lineal desnaturalizante
de 35 a 65% (donde el 100% de desnaturalizante
contiene urea 7M y formamida 40%
(v/v)). Luego se sembraron 38 μL de los productos
de PCR por calle. Las condiciones de electroforesis
fueron a 60 V durante 16 h a 60°C. El gel
fue teñido con GelRed en TAE 1X (0,04 M Tris;
0,02 M Acetato de sodio; 1mM EDTA; pH=7.4)
durante 30 min y visualizado bajo luz UV. Los
perfiles DGGE fueron digitalizados y analizados
con el software Gel Compare II (2005). La posición
y la intensidad de las bandas fueron utilizadas
para el cálculo de diversidad de las muestras
mediante el índice de Shannon-Weaver (H')
y análisis de conglomerados (AC) para observar
la similitud entre los perfiles moleculares.
Análisis estadístico
Los datos fueron analizados con el programa
estadístico Infostat (Di Rienzo et al., 2017).
Se aplicó modelo lineal mixto tomando como
efectos fijos los tratamientos (dosis) del herbicida
y las fechas (días de incubación transcurridos
desde las aplicaciones). Para la diferencia entre
medias se utilizaron test de comparación LSD Fisher
y DGC con un nivel de significancia menor
o igual al 5%.
RESULTADOS
Efectos del glifosato sobre la abundancia
de los grupos funcionales bacterianos
Los tratamientos con glifosato cuyas dosis fueron
de 3,1 y 31 mg ia.Kg-1 s provocaron un incremento
significativo (P ≤ 0,05) en el número
de bacterias fijadoras de N respecto al control
a los 7 y 14 días (Figura 1a). En las nitrificantes,
el tratamiento de mayor dosis 31 mg ia.Kg-1 s aumentó significativamente (P ≤ 0,05) la abundancia
a los 3 y 14 días. En esta última fecha,
la dosis recomendada a campo de 3,1 mg ia.Kg-1 s también superó al control (Figura 1b).
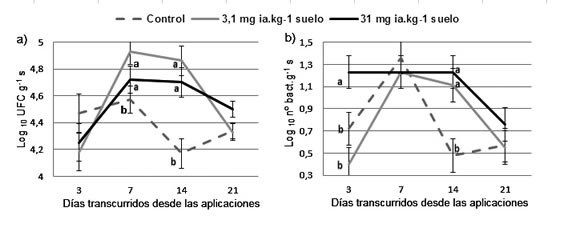
Figura 1. Valores promedio de abundancia de bacterias fijadoras de N (log10 UFC g-1 de suelo) (a) y de nitrificantes (log10 del número
de bacterias g-1 de suelo) (b) según los tratamientos (dosis) y días transcurridos desde las aplicaciones. Las barras indican el error
estándar (n = 3). Letras diferentes indican diferencias significativas (P ≤ 0,05) según LSD de Fisher.
Figure 1. Average values of the abundance of N fixing bacteria (log10 UFC g-1 soil) (a) and nitrifying bacteria (log10 of the number of
the bacteria g-1 soil) (b) according to the treatments (doses) and days after application. The bars indicate the standard error (n = 3).
The different letters indicate significant differences (P ≤ 0.05) according to Fisher's LSD.
El análisis de abundancia de las bacterias heterótrofas
aerobias y celulolíticas muestra que
la aplicación de glifosato no afectó a dicha variable,
pero si existieron cambios significativos en la misma (P ≤ 0,05) con los días transcurridos en el
experimento o incubación (Tabla 1). El número
de ambos grupos aumentó hasta el día 14, fecha
a partir de la cual, la abundancia se mantuvo
en las heterótrofas hasta el día 21; mientras que,
en las celulolíticas disminuyó.
Efectos del glifosato sobre la actividad microbiana,
coeficiente metabólico y C de la biomasa
microbiana
La hidrólisis del DAF presentó un comportamiento
fluctuante similar con los tres tratamientos
evaluados, a excepción de la fecha 14 donde
se observa una disminución significativa (P
≤ 0,05) del 53% con la aplicación de la mayor
dosis de 31 mg ia.Kg-1 s de glifosato respecto
al control (Figura 2). Por el contrario, los valores
de respiración microbiana del suelo (RMS) y coeficiente
metabólico (qCO2) no revelaron efecto del
herbicida, registrándose en ambos, un aumento
significativo con los días transcurridos (P ≤ 0,05)
alcanzando un máximo al día 14 (Tabla 1). En el
C de la biomasa microbiana (C-BM) no se hallaron
diferencias significativas (P > 0,05) entre tratamientos ni fechas, aunque se observó una
tendencia decreciente hacia el día 14.
Tabla 1. Valores promedio y errores estándar de los parámetros microbianos determinados según los tratamientos (dosis) y días
transcurridos desde las aplicaciones.
Table 1. Average values and standard errors of microbial parameters determined according to the treatments (doses) and days after
applications.
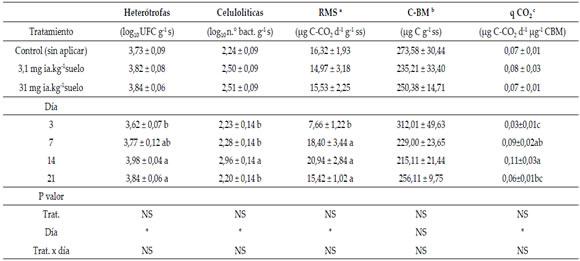
Letras distintas indican diferencias significativas (*P ≤ 0,05) según LSD de Fisher.
Letters refer to significant differences (*P ≤ 0.05) by Fisher LSD.
a Respiración microbiana de suelo. Soil microbial respiration.
b Carbono de la biomasa microbiana. Carbon microbial biomass.
c Coeficiente metabólico. Metabolic quotient.
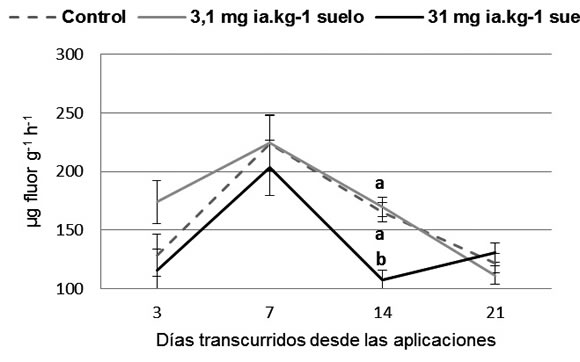
Figura 2. Valores promedio de la actividad enzimática del suelo a partir de la hidrólisis del diacetato de fluoresceína (DAF) (μg
fluoresceína h-1 g-1 de suelo seco) según los tratamientos (dosis de glifosato) y días transcurridos desde las aplicaciones. Las barras
indican el error estándar (n = 3). Letras diferentes indican diferencias significativas (P ≤ 0,05) según LSD de Fisher.
Figure 2. Average values of the enzymatic activity of the soil from the fluorescein diacetate (FDA) hydrolysis (μg fluorescein h-1 g-1 of dry soil) according to the treatments (doses) and days after applications. The bars indicate the standard error (n = 3). Different
letters indicate significant differences (P ≤ 0.05) according to Fisher's LSD.
Efecto del glifosato sobre la diversidad y estructura
microbiana de bacterias oxidantes del
amoníaco (BOA)
El glifosato estimuló la diversidad de las
BOA y el efecto fue diferente según los días
transcurridos desde la aplicación del herbicida
(Figura 3). Si bien a los 3 días de aplicación,
comienza a observarse un incremento de la diversidad
con la dosis mayor (31 mg ia.Kg-1 s)
de glifosato, el mayor valor significativo se detectó
el día 7 con la aplicación de la dosis
a campo (3,1 mg ia.Kg-1 s). Luego se igualaron
los tratamientos sin diferencias significativas
(P > 0,05) con un paulatino descenso en los
valores de diversidad hacia el día 21, indicando
que la comunidad hacia el final del período
estudiado se restablecerse sin diferencias entre
tratamientos. Este resultado también es reflejado
por la estructura de la comunidad representada
en la Figura 4. En general, se observa
la presencia de patrones de bandas similares tanto en número como en la intensidad, entre
los días 3 y 21 y entre los días 7 y 14. Tanto
al inicio (día 3) como al final del experimento
(día 21) se observa que las bandas inferiores
son más intensas que las superiores, lo que
podría estar indicando diferencias en la proporción
de especies y por lo tanto, menor diversidad.
Contrario a lo observado en los patrones
de banda de los días 7 y 14, donde no se observan
diferencias en la intensidad de bandas.
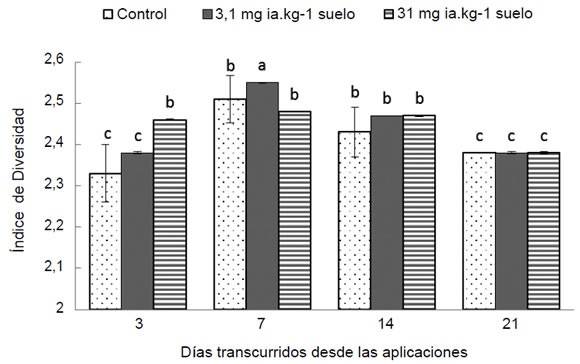
Figura 3. Valores promedio de diversidad de bacterias oxidantes del amoníaco (BOA) según los tratamientos (dosis de glifosato)
y días transcurridos desde las aplicaciones. Las barras indican el error estándar (n = 3). Letras diferentes indican diferencias
significativas (P ≤ 0,05) según DGC.
Figure 3. Average values of diversity of ammonia oxidizing bacteria (AOB) according to the treatments (doses) and days after
application. The bars indicate the standard error (n = 3). Different letters indicate significant differences (P ≤ 0.05) according to DGC.
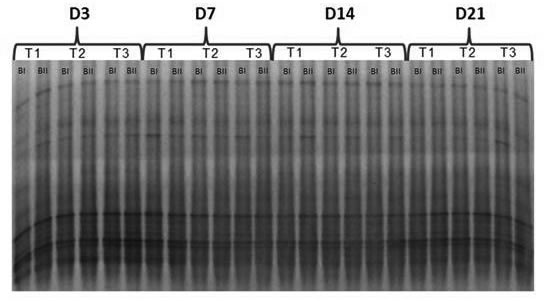
Figura 4. Fingerprinting molecular de BOA en DGGE. T1: Tratamiento control; T2 y T3: Tratamientos de 3,1 y 32 mg ai.Kg-1 s de
glifosato respectivamente. D3, D7, D14 y D21: Días transcurridos desde las aplicaciones del herbicida. BI y BII: Repeticiones de
campo. Nótese el patrón de bandas inferiores más oscuro en los días 3 y 21.
Figure 4. AOB molecular fingerprinting in DGGE. T1: Control treatment; T2 and T3: Treatments of 3,1 and 32 mg ai.Kg-1 s of
glyphosate respectively. D3, D7, D14 and D21: Days after applications of the herbicide. BI and BII: Field replicates. Note the darker
lower band pattern on days 3 and 21.
En el dendrograma (Figura 5), se reflejan las
diferencias estructurales entre fechas representadas
en la Figura 4, más que entre dosis. Con
un 80% de similitud, se formaron dos grupos;
en uno se agruparon las muestras de los días 7 y
14 a las que se les suman las del día 3 (D3)
y dosis mayor (T3); y en el otro, aquellas con los
distintos tratamientos en las fechas 3 y 21.
Figura 5. Dendrograma de similitud expresado en porcentaje a partir del análisis de conglomerados (AC) según Dice y UPGMA.
T1: Tratamiento control; T2 y T3: Tratamientos de 3,1 y 32 mg ai.Kg-1 s de glifosato respectivamente. D3, D7, D14 y D21: Días
transcurridos desde las aplicaciones del herbicida. BI y BII: Repeticiones de campo.
Figure 5. Similarity dendrogram expressed in percentage from the analysis of conglomerates (AC) according to Dice and UPGMA.
T1: Control treatment; T2 and T3: Treatments of 3,1 and 32 mg ai.Kg-1 s of glyphosate respectively. D3, D7, D14 and D21: Days after
applications of the herbicide. BI and BII: Field replicates
DISCUSIÓN
Bacterias del ciclo del carbono
Las poblaciones de bacterias heterótrofas
aerobias y celulolíticas no fueron afectadas por
la aplicación de glifosato pero sí aumentaron con
los días transcurridos en el experimento, debido
probablemente a la utilización de las fuentes carbonadas
del suelo durante el experimento. Esto
indica que, para el suelo en estudio que presenta
un contenido medio de MO, el glifosato podría
no representar una fuente importante de C a dosis
menores a 150 mg ia.Kg-1 s. Al respecto, Zabaloy
et al. (2012) en microcosmos, en un suelo
de contenido medio de MO, observaron un incremento
significativo en el número de bacterias totales
con 150 mg ia.Kg-1 s de glifosato pero no detectaron
cambios con la misma dosis en un suelo
de alto contenido de MO (4,6%). Guijarro et al.
(2018) tampoco detectaron cambios importantes
en comunidades microbianas de suelos con historial
de aplicación y alto contenido de MO (>4%)
al utilizar la dosis de 3 mg ia.Kg-1 s a campo.
Según Newman et al. (2016), el impacto del glifosato
en las comunidades microbianas es regulado
entre otros diversos factores, principalmente
por el contenido de MO del suelo; y Nguyen
et al. (2016) sostienen que la dosis de glifosato
es determinante en la respuesta microbiana, estimulando
el crecimiento a dosis superiores a los
100 mg ia.Kg-1 s. Araujo et al. (2003) detectaron
un aumento en las bacterias totales con 2,16
mg ia.Kg-1 s de glifosato en un suelo con contenido
medio-bajo de MO (2,3%) a los 32 días.
Este resultado supone que podría existir un efecto
tardío de la población bacteriana en responder
a la aplicación. En relación a esto, Mijangos et al.
(2009) observaron que el glifosato a los 15 días
de aplicación, estimuló la actividad y diversidad
funcional de microorganismos heterótrofos con
dosis de 50 y 500 mg ia.Kg-1 s en un suelo con
2,72% de MO. Los autores destacaron el efecto
transitorio sobre la comunidad microbiana del
suelo incluso a dosis elevadas al no observar
lo mismo a los 30 días de aplicado. Ratcliff et al.
(2006) y Bórtoli et al. (2012) con dosis elevadas
de 5000, 2000 y 200 mg ia.Kg-1 s, detectaron
aumentos significativos en la abundancia de bacterias
totales entre los 7 y 55 días de la aplicación
del herbicida en suelos con más del 4% de MO.
A campo, Zabaloy et al. (2008), observaron incremento
en la cantidad de bacterias heterótrofas
aerobias en suelos con un contenido mayor
al 3% de MO y con dosis de 150 mg ia.Kg-1 s de
glifosato a los 3 días de aplicación. Los diversos
hallazgos confirman que los efectos del glifosato
sobre el número de bacterias además de estar
influenciados por el contenido de MO del suelo,
pueden ser dosis dependientes marcadamente
temporales (Ratcliff et al., 2006).
Bacterias del ciclo del N
En este trabajo si bien las BOA respondieron
puntualmente a las dosis aplicadas sólo en los
primeros días del experimento, se destaca que
bajo las condiciones estudiadas, en general, los
grupos funcionales bacterianos del ciclo del N respondieron
positiva y temporalmente a la aplicación
de glifosato demostrando mayor sensibilidad
y capacidad bioindicadora que el resto de los parámetros
medidos. La composición química de la
molecula de glifosato es C3H8NO5P (CAS 1071-
83-6), lo cual podría desencadenar esta respuesta,
ya sea a través del aporte de N lo que favorece
a las bacterias nitrificantes (Van Eerd et al., 2000;
Panettieri et al., 2013); como de P a las bacterias
fijadoras, ya que según Frioni (2006), el mismo
incide en el funcionamiento de la enzima nitrogenasa.
La capacidad de estas bacterias de utilizar
N y P como nutrientes también determina la respuesta,
aún cuando los coloides del suelo puedan
tener influencia en la adsorción de la molecula.
Eberbach (1998) demostró que las primeras etapas
de degradación del glifosato se producen casi
exclusivamente en la fase de suelo no adsorbido,
por lo que el C, N y P de la molécula podrían
estar fácilmente disponibles (Busse et al.,
2001). Estos resultados sugieren que el glifosato
puede actuar como un agente de selección sobre
la biodiversidad del suelo (Bozzo de Brum, 2010;
Rörig, 2012). Newman et al. (2016) mediante
secuenciamiento de muestras de suelo expuestas
a glifosato, demostraron que miembros del grupo
Proteobacterias aumentaron en abundancia relativa.
Sin embargo, en otros trabajos Allegrini et al.
(2015) para Eubacterias y Zabaloy et al. (2016)
para BOA, no han detectado cambios importantes
en la abundancia y diversidad. Los autores atribuyen sus resultados a la elevada variablilidad biológica
entre microambientes, condiciones edáficas
y a la adsorción del herbicida en suelos de alto
contenido de MO (4,65%). Hart et al. (2009)
tampoco observaron cambios importantes en la
estructura de comunidades de hongos y bacterias
desnitrificantes en un suelo con 5% de MO. Contrario
a esto, Angelini et al. (2013) trabajando con
un suelo de 1,48% de MO (contenido bajo), informaron
cambios en la estructura y disminución
en la abundancia y diversidad de las comunidades
de bacterias fijadoras de N con la aplicación
de dosis menores de 150 mg ia.Kg-1 s de glifosato
a campo e invernáculo.
Respiración, coeficiente metabólico
y C de la biomasa microbiana
La respiración microbiana de suelo (RMS)
y el coeficiente metabólico (qCO2), no cambiaron
con las dosis de glifosato utilizadas, detectándose
en ambos un incremento con los días. El C
de la biomasa microbiana (C-BM) tampoco fue
afectado por el herbicida y si bien no cambió con
las fechas, se observó una tendencia de disminución.
Éstos resultados confirman que el glifosato
no significó una fuente importante de C y energía
para el metabolisimo del C en el suelo estudiado.
Al mismo tiempo, existió una mayor liberación
de CO2 por unidad de C-MB. Esto determinó
una baja eficiencia metabólica con el transcurso
de los días provocada probablemente por una reducción
progresiva del C disponible del suelo (Gomez
et al., 2009; Bohm et al., 2011). Nguyen
et al. (2016) a partir de un meta-analisis de varios
suelos, reportaron que la respiración microbiana
no cambió con dosis menores de 100 mg ia.Kg-1 s, indicando que bajo dichas dosis, la RMS podría
ser estimulada en suelos de bajo contenido
de MO comparados con los de mayor contenido.
En experimentos con microcosmos Gomez et al.
(2009) y a campo, Bozzo de Brum (2010) tampoco
detectaron efecto del glifosato en la RMS
trabajando con concentraciones menores de 10
mg ia.Kg-1 en suelos con más del 4% de MO.
Mientras que, Bórtoli et al. (2012) en un suelo
forestal con 5,39% de MO observaron un aumento
significativo en la respiración pero con una dosis
máxima de concentración (2000 mg ia.Kg-1 s);
al igual que Busse et al. (2001) con dosis de 500
y 5000 mg ia.Kg-1 s y Accinelli et al. (2002), con
una dosis de 200 mg ia.Kg-1 en suelos desde 2 a
6,7% de MO.
Por otra parte, la falta de cambios en el C-BM,
coinciden con otros estudios realizados en experimentos
a campo y laboratorio. Según Perucci
et al. (1999), la adsorción de pequeñas cantidades
de herbicida en arcilla o MO limita los efectos
de los agroquímicos en la biomasa microbiana
del suelo. Liphadzi et al. (2005) y Bohm et al.
(2011) con dosis similares y menores a las de este
estudio en suelos con contenido de MO hasta
el 2%, no observaron cambios en el C-BM a campo.
En experiencias de laboratorio, Bórtoli et al.
(2012) y Bohm et al. (2011) tampoco detectaron
cambios importantes con dosis crecientes de glifosato
hasta 2000 mg ia.Kg-1 s utilizando suelos
con más del 3% MO. Jakelaitis et al. (2007) al no
encontrar variación en el C-BM luego de la aplicación
de agroquímicos, concluye que en suelos
con alto porcentaje de MO, los herbicidas podrían
no causar efecto sobre el C-BM. Por otra parte,
un estudio realizado por Haney (2010) en un suelo
de 1,06% de MO, reportó que el glifosato estimuló
la microflora con dosis superiores a los 100
mg ia Kg-1 s a los 56 días de incubación; y concluyó
al igual que Accinelli et al. (2002) en un suelo
con 2,24% MO, que el C-BM no mostró respuesta
al herbicida en un corto período de tiempo aún
a dosis excesivas. Esto podría estar indicando que
el impacto del glifosato sobre el C-BM, además
de estar condicionado por características del suelo
y dosis del herbicida, dependería del tiempo
transcurrido desde la aplicación (Nguyen et al.,
2016) al igual que la abundancia de bacterias
del ciclo del C.
Actividad enzimática del suelo
La hidrólisis del diacetato de fluoresceína
(DAF) ha sido propuesta para estimar la capacidad
hidrolítica global del suelo (Perucci et al.,
1999). Esta capacidad es de enzimas extracelulares
de la microflora edáfica, como proteasas, lipasas
y esterasas (Shaw & Burns, 2006). Según
Andrighetti Scopel et al. (2014), la actividad enzimática
microbiana es considerada un indicador
sensible a los cambios en el ambiente, causados por factores naturales o inducido por el hombre
como la aplicación de pesticidas (Chowdhury
et al., 2008). Además la hidrólisis del DAF representa
un amplio rango de la actividad biológica
del suelo (Perucci et al., 1999), lo que determina
que sea más sensible en responder a cambios
provocados por un disturbio en comparación con
otras técnicas. En este trabajo, si bien para casi
todas las fechas evaluadas el comportamiento
de la hidrólisis del DAF fue similar entre tratamientos,
en la fecha 14 respondió con una marcada
disminución cuando se utilizó la mayor dosis
del herbicida. De esta manera, la reducción en el
contenido de fluoreceína a determinadas dosis podría
estar relacionada con la reducción de la actividad
microbiana de poblaciones funcionalmente
activas sensibles al agroquímico (Bórtoli et al.,
2012). En relación a esto, si bien en este estudio
no se determinaron hongos de suelo, la reducción
en la DAF podría ser una consecuencia de posibles
efectos adversos del glifosato sobre poblaciones
de hongos, ya que según estudios realizados
in vitro por Busse et al. (2001) y Meriles
et al. (2006), el glifosato afectó principalmente
a los hongos de suelo. En coincidencia, Zabaloy
et al. (2008) en microcosmos y utilizando una
dosis de 150 mg ia.Kg-1 s sobre un suelo Argiudol
típico con 4% de MO, observaron una reducción
del 14% en la actividad DAF transcurridos
7 días en comparación con un control. Un estudio
de laboratorio realizado por Weaver et al. (2007)
en un suelo con 1,1% de MO y utilizando dosis
superiores a los 20 mg ia.Kg-1 s, detectaron una
marcada reducción en la actividad microbiana total.
Mientras que, Bortoli et al. (2012) no registró
cambios en la DAF con elevadas dosis del herbicida
en un suelo Haplustol típico de 5,39% de MO.
CONCLUSIONES
Bajo las condiciones de estudio desarrolladas
sobre un suelo Argiudol típico, la aplicación
de glifosato no provocó cambios en la abundancia
de bacterias heterótrofas aerobias, celulolíticas
ni en los procesos microbianos relacionados
al ciclo del C debido probablemente al contenido
de materia orgánica del suelo. Sin embargo, la utilización
de ambas dosis del herbicida aumento
la abundancia de las bacterias del ciclo de N, las
nitrificantes y las fijadoras. El aumento en la diversidad
de las BOA fue temporal con la dosis
de campo. La dosis mayor provocó una disminución
significativa de la actividad enzimática del
suelo para una fecha en particular. Por lo tanto,
este trabajo suma evidencias de que el impacto
del glifosato sobre la microbiota del suelo es variable
y está condicionado por factores edáficos
principalmente por el contenido de materia orgánica
y dosis utilizadas.
BIBLIOGRAFÍA
1. Alef, K.1995. Estimation of the hydrolisis of fluorescein
diacetate. In: K Alef & P Nannipieri (eds.). Methods
in applied soil microbiology and biochemistry. Pp. 232-
233. Academic Press Inc., San Diego. EEUU.
2. Alexander, M. 1965. Most-probable number method for microbial
populations. In: CA, Black (Ed.). Methods of soil
analysis. Part 2 Pp. 1467-1472. Soil Am. Soc. Agron.
Madison, EEUU.
3. Accinelli, C; C Screpanti; G Dinelli & A Vicari. 2002. Shorttime
effects of pure and formulated herbicides on soil microbial
activity and biomass. Int. J. Environ. Anal. Chem.
82: 519-527.
4. Anderson, TH & KH Domsch. 1993. The metabolic quotient
for CO2 (qCO2) as a specific activity parameter to assess
the effects of environmental conditions, such as pH,
on the microbial biomass of forest soils. Soil Biol. Biochem.
25: 393-395.
5. Andrighetti Scopel, M; G Nachtigall Ribeiro; SC Nascimento
de Queiroz; VL Ferracini & MA Záchia Ayub. 2014.
Biodegradação de glifosato pela microbiota de solos cultivados
com macieira. Rev. Bras. Ciência do Solo 38:
1643-1653.
6. Angelini, J; G Silvina; T Taurian; F Ibáñez; ML Tonelli; L Valetti;
MS Anzuay; L Ludueña; V Muñoz & A Fabra. 2013.
The effects of pesticides on bacterial nitrogen fixers
in peanut-growing area. Arch. Microbiol. 195: 683-692.
7. Aparicio, V; E De Gerónimo; D Marino; J Primost; P Carriquiriborde
& JL Costa. 2013. Environmental fate of glyphosate
and aminomethylphosphonic acid in surface waters
and soil of agricultural basins. Chemosphere 93: 1866-
1873.
8. Aparicio, V; E De Gerónimo; K Hernández Guijarro; D Pérez;
R Portocarrero & C Vidal. 2015. Los Plaguicidas agregados
al suelo y su destino en el ambiente. INTA Ediciones.
Balcarce, Buenos Aires; Famaillá, Tucumán; Reconquista,
Santa Fe, Argentina. 73 pp.
9. Araújo, ASF; RTR Monteiro & RB Abarkeli. 2003. Effect
of glyphosate on the microbial activity of two Brazilian
soils. Chemosphere 52: 799-804.
10. Bloem, J; DW Hopkins & A Benedetti. 2006. Enzyme activity
profiles and soil quality. In: J. Bloem; DW Hopkins
& A Benedetti, (eds.). Microbiological methods for assessing
soil quality. Pp. 158-182. CABI international.
11. Bohm, GMB; L Scheneider; D Castilhos; D Agostinetto
& CV Rombaldi. 2011. Controle de plantas daninhas,
biomassa e metabolismo microbiano do solo em função
da aplicação de glifosato ou imazetapir na cultura
da soja. Semin. Agrar. 32: 919-930.
12. Bórtoli, PV.; RA Verdenelli; C Conforto; S Vargas Gil &
JM Meriles. 2012. Efectos del herbicida glifosato sobre
la estructura y el funcionamiento de comunidades microbianas
de dos suelos de plantaciones de olivo. Ecol.
Austral 22: 33-42.
13. Bozzo de Brum, MA. 2010. Persistencia del Glifosato y Efecto
de Sucesivas Aplicaciones en el Cultivo de Soja en Agricultura
Continua en Siembra Directa sobre Parámetros
Biológicos del Suelo. Magister en Cs. Ambientales. Universidad
de la República Oriental del Uruguay, Uruguay.
14. Busse, MD; AW Ratcliff; CJ Shestak & RF Powers. 2001.
Glyphosate toxicity and the effects of long-term vegetation
control on soil microbial communities. Soil Biol.
Biochem. 33: 1777-1789.
15. CASAFE. 2012. Informe del Mercado Argentino de productos
fitosanitarios.
16. Chowdhury, A; S Pradhan; M Saha & N Sanyal. 2008. Impact
of pesticides on soil microbiological parameters and
possible bioremediation strategies. Indian J. Microbiol.
48: 114-127.
17. Conti, ME. 2000. Materia orgánica del suelo. En: ME, Conti
(ed). Principios de Edafología con énfasis en suelos
Argentinos. 2 da edn Pp. 67-86. Editorial Facultad
de Agronomía. Universidad de Buenos Aires. Buenos Aires,
Argentina.
18. Di Rienzo, JA; F Casanoves; M Balzarini; L Gonzalez; M Tablada
& CW Robledo. 2017. Versión 2017. Grupo
InfoStat. FCA. Universidad Nacional de Córdoba,
Argentina. http://www.infostat.com.ar.
19. Eberbach, P. 1998. Applying Non-steady - state Compartmental
Analysis to Investigate the Simultaneous
Degradation of Soluble and Sorbed Glyphosate (N-
(Phosphonomethyl) glycine) in Four Soils. Pestic. Sci.
52: 229-240.
20. Filip, Z. 2002. International approach to assessing soil quality
by ecologically-related biological parameters. Agric.
Ecosyst. Environ. 88: 169-174.
21. Frioni, L. 2006. Anexo Práctico. En: L Frioni, (ed.). Microbiología:
Básica, ambiental y agrícola. Pp. 417-460. Facultad
de Agronomía, Universidad de la República Oriental
del Uruguay. Montevideo, Uruguay.
22. GelCompare II. 2005. Version 4.602 of Applied Maths NV.
23. Gomez, E; L Ferreras; L Lovotti & E Fernandez. 2009. Impact
of glyphosate application on microbial biomass and
metabolic activity in a Vertic Argiudoll from Argentina.
Eur. J. Soil Biol. 45: 163-167.
24. Guijarro, KH; V Aparicio; E De Gerónimo; M Castellote;
EL Figuerola; JL Costa & L Erijman. 2018. Soil microbial
communities and glyphosate decay in soils with different
herbicide application history. Sci. Total Environ. 634:
974-982.
25. Haney, RL. 2010. Effect of glyphosate on soil microbial activity
and biomass. Weed Sci. Soc. Am. 48: 89-93.
26. Hart, MM; JR Powell; RH Gulden; KE Dunfield; K Peter Pauls;
CJ Swanton; JN Klironomos; PM Antunes; AM Koch
& JT Trevors. 2009. Separating the effect of crop from
herbicide on soil microbial communities in glyphosateresistant
corn. Pedobiologia (Jena). 52: 253-262.
27. INTA. 1978. Carta de Suelos de la República Argentina.
Hoja 3363-17 Marcos Juárez. Instituto Nacional de Tecnología
Agropecuaria (INTA). Buenos Aires, Argentina.
28. Jakelaitis, A; JB Santos; R Vivian & AA Silva. 2007. Atividade
Microbiana e Produção de Milho (Zea Mays) e de
Brachiaria Brizantha sob Diferentes Métodos de Controle
de Plantas Daninhas. Planta Daninha, Viçosa-MG 25:
71-78.
29. Jenkinson, DS & DS Powlson. 1976. The effects of biocidal
treatments on metabolism in soil-IV. A method for measuring
soil biomass. Soil Biol. Biochem. 8: 209-213.
30. Kogan, M & C Alister. 2013. Dinámica del glifosato en el
suelo y su potencial actividad vía absorción radicular.
En: A, Ríos (ed.). Variabilidad del glifosato en sistemas
productivos sustentables. Pp. 41-50. Instituto Nacional
de Investigación Agropecuaria (INIA). La Estanzuela,
Uruguay. 165 pp.
31. Kowalchuk, G ; JR Stephen; W De Boer; JI Prosser; TM Embley
& JW Woldendorp. 1997. Analysis of ammonia-oxidizing
bacteria of the beta subdivision of the class Proteobacteria
in coastal sand dunes by denaturing gradient
gel electrophoresis and sequencing of PCR-amplified 16S
ribosomal DNA fragments. Appl. Environ. Microbiol. 63:
1489-1497.
32. Liphadzi, KB; K Al-Khatib; CN Bensch; PW Stahlman;
JA Dille; T Todd; CW Rice; MJ Horak & G Head. 2005.
Soil microbial and nematode communities as affected
by glyphosate and tillage practices in a glyphosate-resistant
cropping system. Weed Sci. 53: 536-545.
33. Meriles, JM; S Vargas Gil; RJ Haro; GJ March & CA Guzman.
2006. Glyphosate and previous crop residue effect on deleterious
and beneficial soil-borne fungi from a peanutcorn-
soybean rotations. J. Phytopathol. 154: 309-316.
34. Mukherjee, S; S Tripathi; AK Mukherjee; A Bhattacharyya &
K Chakrabarti. 2016. Persistence of the herbicides florasulam
and halauxifen-methyl in alluvial and saline alluvial soils, and their effects on microbial indicators of soil
quality. Eur. J. Soil Biol. 73: 93-99.
35. Muyzer, G; E De Waal & A Uitierlinden. 1993. Profiling
of complex microbial populations by denaturing gradient
gel electrophoresis analysis of polymerase chain reaction-
amplified genes coding for 16S rRNA. Appl. Environ.
Microbiol. 59: 695-700.
36. Nakatani, AS; MF Fernandes; RA De Souza; AP Da Silva;
FB Dos Reis-Junior; IC Mendes & M Hungria. 2014.
Effects of the glyphosate-resistance gene and of herbicides
applied to the soybean crop on soil microbial biomass
and enzymes. F. Crop. Res. 162: 20-29.
37. Newman, MM; N Lorenz; N Hoilett; NR Lee; RP Dick; MR Liles;
C Ramsier & JW Kloepper. 2016. Changes in rhizosphere
bacterial gene expression following glyphosate
treatment. Sci. Total Environ. 553: 155-160.
38. Nguyen, DB; MT Rose; TJ Rose; SG Morris & L van Zwieten.
2016. Impact of glyphosate on soil microbial biomass
and respiration: A meta-analysis. Soil Biol. Biochem.
92: 50-57.
39. Okada, E; JL Costa & F Bedmar. 2016. Adsorption and mobility
of glyphosate in different soils under no-till and conventional
tillage. Geoderma 263: 78-85.
40. Panettieri, M; L Lazaro; R López-Garrido; JM Murillo & E Madejón.
2013. Glyphosate effect on soil biochemical properties
under conservation tillage. Soil Tillage Res. 133: 16-24.
41. Perucci, P; C Vischetti & F Battistoni. 1999. Rimsulfuron in a
silty clay loam soil : Effects upon microbiological and biochemical
properties under varying microcosm conditions.
Soil Biol. Biochem. 31: 195-204.
42. Ratcliff, AW; MD Busse & CJ Shestak. 2006. Changes
in microbial community structure following herbicide
(glyphosate) additions to forest soils. Appl. Soil Ecol. 34:
114-124.
43. Rörig, ML. 2012. Estudio de los Cambios Poblacionales
de Microorganismos del Suelo Producidos por el Herbicida
Glifosato. Magister en Cs. Ambientales. Universidad
Nacional de Buenos Aires, Buenos Aires, Argentina.
44. Van Eerd, LL; RE Hoagland; RM Zablotowicz & JC Hall.
2000. Pesticide Metabolism in Plants and Microorganisms:
An Overview. Pestic. Biotransformation Plants
Microorg. 777: 2-27.
45. Vance, ED; PC Brooks & DS Jenkinson. 1987. An Extraction
Method for Measuring Microbial Biomass C. Soil Biol.
Biochem. 19: 703-707.
46. Weaver, MA; LJ Krutz; RM Zablotowicz & KN Reddy. 2007.
Effects of glyphosate on soil microbial communities and
its mineralization in a Mississippi soil. Pest Manag. Sci.
1106: 388-393.
47. Zabaloy, MC; JL Garland & MA Gómez. 2008. An integrated
approach to evaluate the impacts of the herbicides
glyphosate, 2,4-D and metsulfuron-methyl on soil microbial
communities in the Pampas region, Argentina. Appl.
Soil Ecol. 40: 1-12.
48. Zabaloy, MC; E Gómez; JL Garland & MA Gómez. 2012.
Assessment of microbial community function and structure
in soil microcosms exposed to glyphosate. Appl. Soil
Ecol. 61: 333-339.
49. Zabaloy, MC; I Carné; R Viassolo; MA Gómez & E Gomez.
2016. Soil ecotoxicity assessment of glyphosate use under
field conditions: Microbial activity and community
structure of Eubacteria and ammonia-oxidising bacteria.
Pest Manag. Sci. 72: 684-691.




